Установка стена при раке пищевода
Обновлено: 06.05.2024
Установка стена при раке пищевода
М. П. Королев, Л. Д. Роман, Л. Е. Федотов, А. А. Смирнов, Р. М. Лукьянчук
ГОУВПО Санкт-Петербургская Государственная Педиатрическа Медицинская Академия, СПБГУЗ «Мариинская больница», Ленинградский Областной Онкологический Диспансер
г. Санкт- Петербург
Стриктуры пищевода различной этиологии клинически появляются дисфагией. Это тяжелое осложнение неизбежно вызывает истощение больного. Полтора столетия тому назад впервые была выполнена операция гастростомия. Она долгие годы оставалась основным методом лечения ослабленных и инкурабельных больных со стенозами пищевода. Однако этот метод значительно ухудшает качество жизни, является дополнительной психологической травмой, лишает больных возможности естественного приема пищи. Альтернативой гастростомии являются различные методики протезирования пищевода, которые в применяются уже более 100 лет. Однако широкое распространение методика стентирования получила только в последние 15 лет. Это связано с внедрением в практику «саморасширяющихся» стентов, имеющих значительный внутренний диаметр (20-25мм). В отличие от жестких эндопротезов, установка саморасширяющегося стента сопряжена с меньшим риском кровотечения или перфорации, к тому же не требуется избыточной предварительной дилатации пищевода, так как доставочное устройство имеет небольшой диаметр. К преимуществам саморасправляющихся стентов можно отнести постоянное дилатирующее воздействие на стенку пищевода, незначительую толщину его стентки, а также наличие силиконовой пленки, что способсвует герметизации просвета пищевода и препятсвует прорастанию опухолевых масс. Все эти качества делают саморасширяющиеся стенты незаменимыми как для устранения дисфагии, так и для лечения пищеводных свищей. К недостаткам стентов относятся возможность их смещения в момент установки, обтурация опухолевыми разрастаниями по краям, способность скольжения в дистальном направлении, трудность удаления или передислокации, а так же высокая стоимость.
Современные металлические стенты:
Стенты изготавливают или из нитинола (титано-никелевый сплав) или из нержавеющей стали. Они находятся в сжатом состоянии внутри системы доставки малого калибра (10-16F). Нитинол обладает температурной памятью, что обеспечивает его расправление под действием температуры тела. Большинство стентов на проксимальном конце имеет расширение для предупреждения дистальной миграции, а в структуру покрытых стентов включены участки, лишенные оболочки для более прочной фиксации. В литературе нами обнаружены описания следующих типов современных стентов:
- Gianturco — Z стент (Cook UK ltd). Изготовлен из нержавеющей стали с полиэтиленовым покрытием и расширением на концах для предупреждения миграции. Для стентирования зоны кардии разработаны типы с антирефлюксным дистальным клапаном.
- Ultraflex (Boston Scientific ltd). Изготовлен из Nitinol сетки, выпускается в вариантах с покрытием и без него. Обладает наименьшей радиальной упругостью, но наибольшей гибкостью. Эти виды стентов предпочтительны для извитых стриктур и стриктур верхней трети пищевода.
- Flamingo Wallstent (Boston Scientific ltd). Суживающийся стент, изготовленный из нержавеющего сплава и покрытый только изнутри. Разработан для применения только в зоне кардии, т. к. его коническая форма предупреждает дистальную миграцию.
- Wallstent (Boston Sdientific ltd). Стент с расширениями на концах с внутренним силиконовым покрытием изготовлен из нержавеющего сплава, вплетенного в трубчатую сетку.
- Esophacoil (Kimal plc). Стент без покрытия изготовлен из простой Nitinol нити.
- Ferx — Ella stent (Radiologic ltd). Изготовлен из нержавеющей стали с наружным и внутренним полиэтиленовым покрытием, снабжен дистальным антирефлюксным клапаном.
- Choo Stent (Diagmed). Изготовлен из Nitinol с полиуретановым покрытием, снабжен прикрепленной нитью для извлечения. Также разработан вариант с внутренним дистальным антирефлюксным клапаном.
- Memotherm (C. R. Bard). Плетенный Nitinol стент с внутренним и наружным PTFE покрытием.
- Song стент. Модифицированный Gianturco Z-стент, изготовленный из нержавеющей стали с полиуретановым покрытием. Также имеется извлекаемый вариант с прикрепленной нитью
Для систематизации большого количества данных найденных в литературе мы позволили себе составить классификацию стентов.
Классификация стентов:
- Металлические — различные сплавы металлов (нитинол, нержавеющая сталь и др.)
- Пластиковые
- Биодеградирующие
- Непокрытые
- Покрытые
- Частично покрытые
- Верхняя треть пищевода – «шейный» стент, ассиметричный стент и др.
- Средняя треть пищевода – «классические» пищеводные стенты
- Нижняя треть пищевода, кардия — стенты с антирефлюксным клапаном, «конусообразные» стенты.
- Фиксирующие механизмы — крючья, нити.
- Комбинация стентов- Niti-S stent, комбинация стентов Polyflex.
- Mushroom stent- дистальное расширение каркаса стента для установки в область пищеводно-желудочного анастомоза.
Показания к стентированию:
Опухолевые стиктуры пищевода, послеоперационные рецидивы опухоли в зоне анастомоза, компрессия пищевода извне, эзофагореспираторные свищи различной этиологии, несостоятельность эзофагоэнтероанастомозов, доброкачественные стриктуры анастомозов, послеожеговые рубцовые стриктуры пищевода, постлучевые стриктуры пищевода. Также нами однократно установлен стент по поводу длительно (более 40 лет) существующего кардиоспазма.
Материал:
За период с 2004 года по настоящее время нами было выполнено эндоскопическое стентирование 192 больным с клиникой дисфагии, из них 117 по поводу рака пищевода (70 %), 25 с гастроэзофагеальным раком (13 %), 20 по поводу рецидивов рака после резекции в области пищеводного анастомоза (10,5 %), 13 с пищеводно-респираторными свищами (6,8 %), 5 с компрессией пищевода извне (2,6 %), а также 6 случаев доброкачественных стриктур пищеводных анастомозов (3,1 %), 2 с рубцовыми послеожеговыми стриктурами пищевода (1 %), 2 с несостоятельностью эзофагоэнтероанастомоза (1 %), 1 с постлучевой стриктурой пищевода (0,5 %), 1 с кардиоспазмом (0,5 %). Возрастной интервал пациентов от 18 до 93 лет. Степень дисфагии оценивалась нами по бальной шкале (Bown). Подавляющая масса больных имела дисфагию 3 и 4 балла (92 %). Большинству пациентов были установлены нитиноловые стенты фирмы M. I. Tech (Корея) 182(94,8 %), также использовались стенты фирмы Wilson-Cook (США) 10(5,2 %).
Методика подготовки:
Перед стентированием больным проводилось эндоскопическое и рентгенконтрастное исследования для определения уровня, характера и протяженности сужения, а также, проводилась биопсия опухолевой ткани. Учитывая тяжесть состояния больных, проводилась инфузионная терапия для коррекции водно-электролитных нарушений. Только установление диагноза респираторно-пищеводного свища являлось показанием для срочной установки саморасширяющегося стента, так как промедление, в данном случае, вызывало ухудшение состояния пациента в связи с прогрессированием симптомов аспирации. Были выделены следующие причины развития эзофаго-респираторных фистул: местное распространение опухоли, травмы пищевода при эндоскопическом лечении стриктур, пролежни в области раздувной манжетки при длительно сущестующей трахеостоме.
Методика установки стента:
Введение стента в пищевод производилось после премедикации (атропин, реланиум) под общей или местной анестезией в положении больного на левом боку. При выраженности стриктуры перед стентированием проводили сеанс бужирования по струне направителю до размеров доставочного устройства (6-8мм), если уровень и протяженность сужения были известны заранее, или до размеров аппарата (10мм), если было необходимо оценить нижнюю границу сужения. После эзофагоскопии и введения струны, под эндоскопическим контролем устанавливался проксимальный край стента на 2,0-3,0 см выше края опухоли. По направителю в зону стеноза подводили стент в сжатом состоянии, после чего он выталкивался и расправлялся в просвете пищевода. Затем направитель извлекали.
Наш опыт как было отмечено выше показывает, что эндоскопической техники вполне достаточно для стентирования пищевода, а рентгеноскопия пищевода необходима в дальнейшем для контроля проходимости и положения эндопротеза. Однако в двух случаях нами была использована методика ретроградного проведения струны-направителя, всвязи со значительной выраженностью стриктуры. В одном из случаев была использована еюностома по Ру, а в другом в условиях операционной была наложена временная гастростома, для доступа к пищеводу через желудок.
Для установки эндопротеза под эндоскопическим контролем стент должен был обладать определенными характеристиками, такими как прозрачный кожух доставочного устройства (для визуального контроля движения стента при его открытии), механизмы коррекции положения протеза (на проксимальном и дистальном концах стента), возможность фиксации стента после раскрытия (технология Shim- трансназальное закрепление стента к ушной раковине). Применяли различные методы для контроля результатов эндопротезирования: рентгенологический, эндоскопический, а также их комбинацию.
Рентгенологический контроль с контрастным веществом (76 % урографин) проводился в различные сроки после манипуляции и зависел от хода и непосредсвенного успеха манипуляции.
Результаты:
У подавляющего большинства больных с дисфагией уже на следующие сутки после стентирования, появлялась возможность приема жидкой и полужидкой пищи, а через 3-5 суток явления дисфагии полностью исчезали. Особо выраженный эффект наблюдали при неопухолевых стриктурах. При выполнении стентирования по поводу эзофагореспираторных свищей удавалось во всех случаях добиться герметизации пищевода с исчезновением симптомов аспирации.
У 100 % пациентов подвергшихся стентированию наблюдалось улучшение проходимости в области сужения.
Выводы:
Учитывая малую травматичность эндоскопического стентирования эта манипуляция является альтернативой традиционным операциям на пищеводе.
Методика показана больным с неоперабельными формами рака, а также ослабленным больным страдающим пищеводно-респираторными свищами.
Эндоскопическое стентирование имеет значительный выигрыш в качестве жизни по сравнению с гастростомией позволяя больным продолжить питание через рот, тем самым в большей степени сохраняя их психологическое здоровье.
Эндоскопическое стентирование
Стентирование — это способ восстановления просвета полого органа при помощи специального устройства — стента, который представляет собой тончайший металлический каркас, как правило, в форме цилиндра, способный восстанавливать форму трубчатых органов, измененную сдавлением либо врастанием опухоли.
Стентирование используется в практике онкологической гастроэнтерологии для восстановления просвета пищевода, желудка, двенадцатиперстной кишки, толстой кишки и желчевыводящих протоков, а также в пульмонологии для восстановления просвета трахеи и крупных бронхов. Этот вид вмешательств решает серьезные задачи, не прибегая к «большой хирургии», т. е. самым малоинвазивным способом.
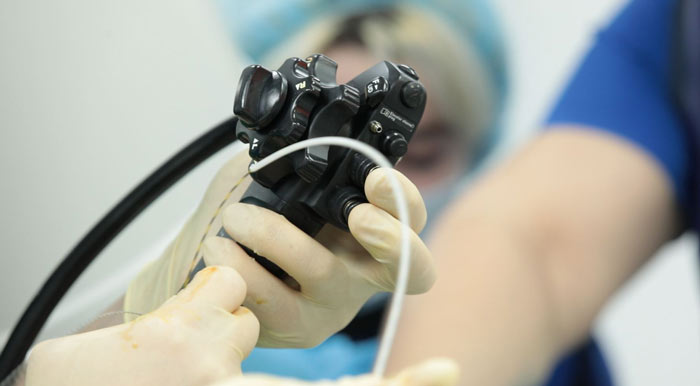
Преимуществом эндоскопических методик является их высокая эффективность, минимальное количество осложнений, максимально быстрая реабилитация пациентов и существенное улучшение качества жизни за счет уменьшения количества дней, необходимых для реабилитации и сохранением физиологических функций стентируемого органа.
Команда врачей, проводящих эндоскопические вмешательства
Эндоскопическая хирургия в лечении онкологических пациентов требует от хирурга высокой точности, виртуозного владения методиками стентирования и немалого опыта. Нашим коллективом врачей под руководством доктора медицинских наук М. С. Бурдюкова выполнено:
- Более 1500 эндоскопических операций на желчных протоках;
- Более 250 эндоскопических стентирований при опухолях пищевода;
- Более 150 стентирований при опухолях желудка;
- Более 170 стентирований по поводу опухолей двенадцатиперстной кишки;
- Более 150 стентирований при опухолях толстой кишки;
- Более 75 эндоскопических операций у пациентов, ранее перенесших серьезное хирургическое вмешательство.
Эндоскопическое лечение отличает высокая эффективность с минимумом осложнений. Пациенты максимально быстро восстанавливаются, существенно улучшается качество их жизни, а функции стентируемого органа сохраняются.
Врачи «Евроонко» успешно применяют различные виды стентов, в том числе инновационные модели Hot AXIOS американской компании Boston Scientific Corporation. Эти стенты имеют форму «гантели» с расширениями на концах, за счет чего надежно удерживаются в нужном месте. Благодаря большой ширине просвета, в них, в отличие от других моделей, крайне редко возникает непроходимость, через них можно свободно выполнять эндоскопические вмешательства: дренирование (выведение жидкости), некрэктомию (удаление погибших тканей).

Далее мы остановимся чуть подробнее на стентировании желудочно-кишечного тракта, стентировании желчевыводящих путей, а также трахеобронхиального дерева.
Стентирование желудочно-кишечного тракта (ЖКТ)
Стентирование желудочно-кишечного тракта — это малоинвазивный способ восстановления проходимости желудочно-кишечного тракта за счет установки стента. Это вмешательство проводится под двойным контролем: эндоскопическим и рентгенологическим, что позволяет максимально контролировать процесс и выполнять прецизионные, уникальные по своей точности операции.
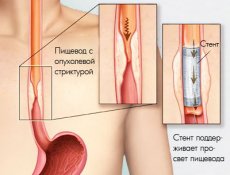
Стентирование — это оптимальный способ помощи пациентам с опухолевыми и доброкачественными стриктурами (сужениями) ЖКТ, которым хирургическое лечение не показано в виду распространенности опухолевого процесса или при наличии противопоказаний к его проведению, а также, в некоторых случаях — как метод временной помощи перед предстоящим оперативным вмешательством.
Чаще всего стентирование применяется при следующих заболеваниях:
- опухоли пищевода, пищеводно-желудочного перехода, желудка, двенадцатиперстной кишки, толстой кишки;
- прорастание (компрессия) злокачественными опухолями смежных органов (при опухолях легкого);
- рецидив опухоли в области анастомоза после оперативного лечения;
- пищеводно-респираторные свищи;
- несостоятельность анастомозов после операции;
- доброкачественные стриктуры пищевода и анастомозов;
- перфорации пищевода, в том числе ятрогенные.

В этом случае цель вмешательства — улучшение качества жизни пациента за счёт восстановления пассажа пищи, жидкости и лекарственных препаратов по ЖКТ; возможность полноценного питания и приёма химиопрепаратов естественным способом. А также подготовка пациента к оперативному лечению, проведению химиотерапии и другим специфическим методам лечения.
Всю необходимую информацию о подготовке к стентированию в каждом конкретном случае пациент получает от лечащего врача. Но общим правилом является следующее: воздерживаться от приема пищи в течение определенного времени перед вмешательством.
Проведение процедуры стентирования
Установка стента проводится в условиях медикаментозного сна, поэтому, никаких болезненных ощущений и дискомфорта пациент не испытывает. Время, затрачиваемое на выполнение стентирования, зависит от уровня расположения сужения, типа выбранного для установки стента и обычно составляет 15–45 минут. После выполнения эндоскопического стентирования пациенту выдается документ, содержащий протокол исследования и заключение. Протокол содержит детальное описание хода вмешательства. Врач, выполнявший стентирование, подробно пояснит о дальнейшем режиме питания, выдаст на руки краткую памятку. По желанию ход исследования может быть записан на диск, о чем необходимо предупредить медицинский персонал заранее.
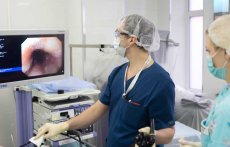
В течение 30 минут после процедуры не следует пить. После выполнения вмешательства пациенту (либо его родственникам) выдается памятка, в которой указаны все необходимые рекомендации по течению послеоперационного периода, особенностях диеты и состояниях, которые возникают у пациента после стентирования. Рекомендуется проинформировать врача-эндоскописта при появлении необычных симптомов и любых тревожащих обстоятельствах в первые часы и дни после исследования.
Альтернативы стентированию
Для избавления пациента от дисфагии (невозможности употреблять пищу) и обеспечения адекватного уровня качества жизни используется множество методов. Среди них хирургические, сопряженные с высокой частотой осложнений, летальностью, длительностью стационарного лечения и более высокой его стоимостью. Часто такие вмешательства не приводят к улучшению качества жизни. Использование других эндоскопических методов для реканализации просвета (например,электро- и лазерной коагуляции, бужирования, баллонной дилатации) требует длительного лечения с повторением сеансов, при этом их эффективность является кратковременной.
Осложнения стентирования
Поскольку стентирование это малоинвазивный метод восстановления проходимости желудочно-кишечного тракта, имеется риск возникновения как обычных, связанных с выполнением эндоскопического исследования, так и своих специфических осложнений. Частота серьёзных осложнений при проведении диагностического исследования достаточно низка и не превышает 0,01%. Подавляющее большинство осложнений могут быть скорректированы эндоскопическим или медикаментозным способом.
Стентирование желчевыводящих путей
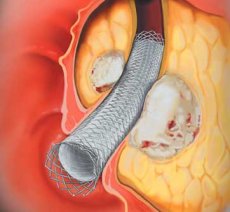
Стентирование желчевыводящих путей — малоинвазивный эндоскопический способ восстановления проходимости желчных путей при механической желтухе путем установки в желчные протоки на уровень сужения стента, который открывает просвет протоков и восстанавливает беспрепятственный отток желчи из печени в двенадцатиперстную кишку. Это вмешательство позволяет сохранить естественный желчеотток, что, во-первых, резко повышает качество жизни (не нужно ходить с выходящими наружу дренажами), кроме того, естественное поступление желчи не приводит к потере важных веществ, а также стимулирует нормальную работу кишечника.
Вмешательство проводится под двойным контролем: эндоскопическим и рентгенологическим, поскольку необходима точность движений и навигации даже большая, чем при стентировании ЖКТ.
Стенты, устанавливаемые в желчные протоки — билиодуоденальные стенты, иногда еще называют «потерянные» стенты. Имеется в виду, что после его установки пациент может о нем смело забыть: стент не требует обслуживания, никак не дает о себе знать, таким образом, после разрешения механической желтухи ничто не напоминает о проведенном вмешательстве.
Билиодуоденальное стентирование является оптимальным способом восстановления желчеоттока у пациентов с механическим блоком желчных протоков. Пациентам с опухолевыми и доброкачественными стриктурами ЖКТ, которым хирургическое лечение не показано в виду распространенности опухолевого процесса или при наличии противопоказаний к его проведению, а также, в некоторых случаях, как метод временной помощи перед предстоящим оперативным вмешательством.
Стентирование желчных протоков применяется при следующих заболеваниях, вызывающих затруднение желчеоттока и механическую желтуху:
- Опухоль поджелудочной железы, большого дуоденального сосочка, внепеченочных желчных протоков, двенадцатиперстной кишки;
- Метастатическое поражение печеночно-двенадцатиперстной связки;
- Желчекаменная болезнь, осложненная холедохолитиазом;
- Хронический панкреатит;
- Кисты поджелудочной железы;
- Постхолецистэктомический синдром;
- Стриктуры желчных протоков после различных операций на желчном пузыре и печени.
Методы лечения механической желтухи включают в себя восстановление оттока желчи, а также медикаментозную терапию, направленную на восстановление функции печени, избавление органов и тканей от накопленного избыточного билирубина.
Цель стентирования желчных протоков — это улучшение качества жизни пациентов за счёт восстановления пассажа желчеоттока наиболее физиологическим и безопасным способом — эндоскопическим. Способом, после которого в максимально быстрые сроки происходит восстановление функции печени. Стентирование желчных протоков, а также другие виды операций на желчном дереве, выполняемые эндоскопически являются либо самостоятельным и окончательным методом оказания помощи пациентам, либо подготовительным этапом перед операцией или проведением других, специфических методов лечения, например, таких как химиотерапия.
Установка билиодуоденального стента проводится в условиях медикаментозного сна и не вызывает никаких болезненных ощущений. Время, затрачиваемое на выполнение стентирования, зависит от уровня расположения, анатомических особенностях пациента, в частности анатомии панкреатобилиарной зоны, особенностей выполняемого вмешательства, типа и количества выбранных стентов. Обычно это 45–60 минут.
В течение суток после вмешательства пациенту рекомендуется соблюдать постельный режим и воздержаться от приема пищи. После выполнения вмешательства пациенту (либо его родственникам) выдают памятку, в которой указаны все необходимые рекомендации по течению послеоперационного периода, особенностях диеты и состояниях, которые возникают у пациента после стентирования. Рекомендуется проинформировать врача-эндоскописта при появлении необычных симптомов и любых тревожащих обстоятельствах в первые часы и дни после исследования.
Чрескожное дренирование внутрипечёночных желчных протоков или желчного пузыря это альтернативный метод лечения, который применяют при высоких блоках желчеотведения, когда имеются технические ограничения для эндоскопического стентирования.
Преимущества эндоскопического метода:
- малая инвазивность,
- статистически доказанная большая безопасность по сравнению с другими альтернативными способами восстановления желчеоттока,
- возможность удаления камней при холедохолитиазе,
- обеспечение физиологичного оттока желчи у большинства пациентов.
Осложнения также редки как и при других вариантах эндоскопического стентирования. Подавляющее большинство осложнений могут быть скорректированы эндоскопическим или медикаментозным способом.
Стентирование трахеобронхиального дерева
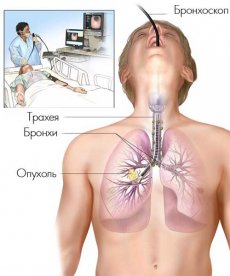
Стентирование трахеобронхиального дерева — это малоинвазивный способ восстановления проходимости трахеи и главных бронхов, обеспечивающий доступ воздуха к легочной ткани путем установки на уровень сужения стента. Вмешательство проводится под двойным контролем: эндоскопическим и рентгенологическим.
Стентирование является одним из способов помощи пациентам с опухолевыми и доброкачественными стриктурами трахеи и бронхов, страдающих выраженной дыхательной недостаточностью, которым хирургическое лечение не показано в виду распространенности опухолевого процесса или при наличии противопоказаний к его проведению. В некоторых случаях стентирование применяется для временной помощи перед предстоящим оперативным вмешательством, либо, при наличии перспективы от планируемой химиотерапии, как временный этап оптимизации дыхательной деятельности до момента ответа опухоли на химиотерапию.
Применяется при следующих заболеваниях:
- центральный рак лёгкого с вовлечением трахеи или главных бронхов,
- стриктуры трахеи или бронхов после длительного нахождения пациента на искусственной вентиляции легких,
- компрессия трахеи и главных бронхов увеличенными лимфатическими узлами,
- пищеводно-респираторные свищи,
- несостоятельность анастомозов после операции.
Целью вмешательства является улучшение качества жизни пациентов за счёт обеспечения доступа кислорода к легочной ткани путём восстановления просвета обтурированного бронха либо трахеи; подготовка пациента к оперативному лечению, проведению химиотерапии и другим специфическим методам лечения, реабилитация пациентов после длительного нахождения в условиях искусственной вентиляции лёгких, осложненной формированием стриктуры в месте стояния интубационной трубки, либо трахеостомы.

Установка стента проводится в условиях медикаментозного сна, поэтому, никаких болезненных ощущений и дискомфорта пациент не испытывает. Время, затрачиваемое на выполнение стентирования зависит от уровня расположения сужения, типа выбранного для установки стента и обычно составляет 15–45 минут.
Для избавления пациента от асфиксии и обеспечения адекватного уровня качества жизни используется множество методов:
- Хирургический метод в виду либо распространенности опухолевого процесса, либо морфологическим особенностям строения опухоли не всегда показан.
- Использование других эндоскопических методов для реканализации просвета — электро- и лазерной коагуляции, бужирования, баллонной дилатации — требует длительного лечения с повторением сеансов, при этом их эффективность является кратковременной.
- Выжидательная тактика направлена на получение ответа от проведения химиотерапии, однако, при выраженных симптомах дыхательной недостаточности, химиотерапевты могут отказаться от её проведения до коррекции дыхательной недостаточности.
Осложнения крайне редки и в случае возникновения могут быть скорректированы эндоскопическим способом.
Как лучше перенести стентирование?
Чтобы комфортно себя чувствовать во время стентирования, пациенту необходимо быть морально настроенным к исследованию, быть к нему подготовленным, знать, что исследование для него безопасное, знать, что он доверяет свое здоровье профессионалам.
Моральный настрой пациента может складываться из следующих факторов:
- вмешательство все равно необходимо сделать,
- от результатов вмешательства зависит здоровье,
- в клиниках «Евроонко» исследование выполняют только высококвалифицированные доктора.
В таком случае, во время проведения стентирования вы будете максимально расслаблены, что является одним из наиболее важных факторов, влияющих на успешность и эффективность проведения вмешательства.
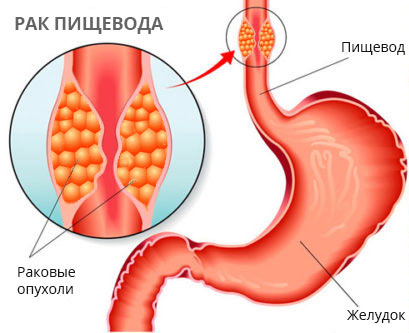
Рак пищевода
Рак пищевода встречается нечасто, ежегодно поражает чуть более 7,5 тысяч россиян или 8–9 человек из 100 тысяч населения, преимущественно пожилого возраста. Самые высокие показатели, двадцатикратно превышающие российские, отмечены в Китае, Корее, Японии, Монголии, Иране и Бразилии.
В структуре мужской онкологической заболеваемости рак пищевода взял 2, 5%, тогда как среди женских раков — только 0,5%. Это совсем не женское заболевание, мужчины болеют почти в четыре раза чаще и начинают болеть раньше. В мужской когорте средний возраст выявления онкологического поражения пищевода 64 года, то в женской — после 70 лет.
Факторы риска
Рак пищевода одна из самых скрытно текущих опухолей, поскольку пищеводная трубка достаточно растяжима и даёт знать о неблагополучии при сужении просвета более чем на две трети. Пациенты обращаются к врачу, когда может просочиться только вода. При эндоскопическом исследовании желудка пищевод «пролетают», планируя осмотр слизистой желудка в плане диспансеризации или контроль хронической язвы желудка, и если не иметь намерения что-то прицельно найти в пищеводе, то походя ничего и не обнаружат.
Есть ещё одна проблема — проблема личности. Для жителей Средней Азии, пьющих обжигающий чай, рак пищевода — традиционная болезнь. Злокачественная опухоль пищевода поражает пьющих крепкие алкогольные напитки, курящих, потребляющих некачественную пищу. Не минует рак пищевода и граждан с избыточным весом.
Также вероятность развития злокачественного новообразования повышает наличие грыжи пищеводного отверстия диафрагмы при которой происходит заброс желудочного содержимого в неприспособленный для такой агрессивной среды пищевод. Регулярно «обжигаемый» соляной кислотой пищевод даёт знать о себе гастро-эзофагеальной рефлюксной болезнью, коротко именуемой ГЭРБ.
Второе заболевание, с довольно высокой частотой приводящее к развитию аденокарциномы пищевода — пищевод Барретта. При пищеводе Барретта нормальный природный плоский эпителий слизистой оболочки в месте перехода в желудок локально, буквально гнёздами, замещается нетрадиционным цилиндрическим эпителием, такое состояние частичной замены называется метаплазией. И то воздействие различных жизненных факторов, которое легко переносит плоский эпителий, совершенно не подходит цилиндрическому, он страдает и сбивается с курса, давая рост раковым клеткам. Все больные пищеводом Барретта должны наблюдаться и лечиться, во избежание развития рака.
Эти факторы риска развития рака пищевода устранимы. Но есть и неустранимый — ахалазия пищевода, двадцатикратно увеличивающая вероятность рака. Заболевание обусловлено ненормальным регулированием нервной системой сокращений пищевода при передвижении по нему пищи и правильного открытия сфинктера у входа в желудок. Пищевод сужается циркулярными рубцами, а над сужением возникает чрезмерное расширение. Особенность в том, что твёрдая пища проходит легко, а вот жидкая — плохо. При этом состоянии пища проходит очень плохо, подолгу застаиваясь в расширении и формируя хроническое воспаление слизистой оболочки. При воспалении начинается избыточное деление клеток эпителия слизистой, и сбой одной клетки с правильной программы может дать начало раку.
Клиническая картина
В пищеводе есть физиологические сужения, где преимущественно и начинается злокачественный рост. Сужения эти обусловлены прохождением вблизи других анатомических образований — аорты и развилки трахеи на бронхи, в местах перехода глотки в пищевод и пищевода в желудок тоже имеется небольшое сужение. Считается, что здесь слизистая более подвержена мелким травмам грубой пищей, значит, чаще возникает воспаление. Тем не менее, в шейном отдела частота рака составляет 10%, в нижней трети пищевода — 30%, а 60% раков образуется в среднем сегменте.
Злокачественные клетки не только растут в толщу органа, как бывает при большинстве раковых образований, они ещё и мигрируют по мелким лимфатическим сосудикам. Сосудики формируют внутри пищеводной стенки полноценную лимфатическую сеть, распространяя опухоль внутри, поэтому протяжённость опухоли может быть и 5, и 10, и 15 сантиметров.
В запущенной стадии локализация определяет симптоматику, а первыми признаками считается ощущение прилипания пищи к одному и тому же месту или царапание слизистой кусочком еды. По мере прогрессирования появляется затруднённое прохождение сначала твёрдых кусочков, потом каши, далее жидкости. Всё этот называется дисфагия. Сначала пациент запивает кусочки еды водой, проталкивая их, после это уже не помогает, нарушается питание, человек худеет. Соприкосновение опухоли с пищей приводит к воспалению, появляется неприятный гнилостный запах, при регулярной травме рыхлая слизистая опухоли начинает кровоточить, может развиться опасное для жизни кровотечение.
Присоединяются боли, поскольку пищевод сокращается перистальтическими волнами, боль имеет спастический характер. Прорастание опухоли через всю толщу пищеводной стенки делает боль постоянной, локализуется она между лопатками. Инфильтрация опухолью клетчатки средостения вовлекает в процесс возвратный нерв, отвечающий за движение голосовых связок, появляется осиплость и попёрхивание при питье. Нерв могут сдавить увеличенные метастазами лимфатические узлы и пропадёт звучность голоса.
Как и при ахалазии, над сужением пищевода опухолью образуется расширение, где копится еда. Ночной заброс скопившихся пищевых масс в дыхательное горло тоже может привести к пневмонии. А днём беспокоит сильная слабость, температура. Если в процесс вовлечены дыхательные пути, то может сформироваться соустье между пищеводом и трахеей или крупными бронхами — свищ, по которому крошки еды будут попадать в дыхательную трубку, вызывая кашель и пневмонию. Если такой свищ откроется из пищевода в клетчатку средостение, то её воспаление приведёт к смерти.
Диагностика
Современная диагностика, сделавшая с конца прошлого века рывок в развитии, активному выявлению опухоли пищевода помогает мало, только у 6,4% из всех заболевших опухоль находят до появления ярких клинических признаков. Как и в докомпьютерную медицинскую эру рак пищевода на I–II стадии выявляют только у 28,2%, на III стадии — у 36,4%, и треть попадает к доктору уже с отдалёнными метастазами. По причине запущенности 60% больных с момента выявления рака не проживут и года, а 5 лет проживают только 32,3%.
Статистические показатели у россиян хуже только при раке печени и поджелудочной железы, действительно высокозлокачественных опухолях с весьма высоким метастатическим потенциалом. По степени злокачественности рак пищевода отнюдь не под стать им, просто у 73% рак выявляется в распространённом варианте, когда возможности терапии ограничены сугубо паллиативной помощью.
Лечение рака пищевода
Главный и основной метод терапии — хирургия, но выявление опухоли в запущенном состоянии при невозможности замены всей пищеводной трубки аналогичной анатомической структурой — техническое ограничение хирургических возможностей, не всегда даёт желаемый результат. Поэтому к операции подключают лекарственную и лучевую терапии. Выбор ведущего метода лечения диктуется размерами и локализацией опухоли, состоянием больного и сопутствующими заболеваниями.
- При очень небольшой опухоли, не прорастающей слизистую, выполняют резекцию только слизистой с подлежащим слоем с помощью гастроскопа, и результаты лечения очень хорошие.
- При I‑II стадии рака часть пищевода удаляется, дефект заполняют сегментом кишки или формируют трубку из желудка. Сегодня возможно использовать эндоскопическое оборудование при этих операциях.
- При распространении опухоли в мышечный слой и далее тоже делается операция, но в этом случае результаты не очень хороши, поэтому её дополняют предоперационной химиотерапией или облучением. В некоторых случаях, когда невозможно радикально удалить опухоль, ограничиваются химиолучевой терапией.
- Предоперационная химиотерапия максимальный выигрыш даёт при аденокарциноме, в некоторых случаях проводят несколько курсов до операции и несколько после.
- Профилактическую терапию после радикальной операции не проводят из-за малой эффективности.
- Без химиотерапии эффективность лучевой терапии тоже невысока, методы лучше совмещать, тогда операцию делают через 6–8 недель после завершения консервативного лечения, такой комплексный подход позволяет прожить 5 лет ещё 13% больных.
- Иногда химиолучевое лечение проводят при недостаточной радикальности операции.
- Химиолучевое лечение может проводиться при невозможности операции, когда опухоль слишком большая, или при маленькой опухоли, но с общими противопоказаниями к операциям. В этом консервативном варианте выживаемость сравнима с хирургическим лечением.
- При наличии свищей химиолучевое лечение невозможно.
- Химиолучевое лечение может осложниться острым воспалением слизистой пищевода, которое потребует перевода на питание «через капельницу».
В онкологической гастроэнтерологии для восстановления просвета пищевода часто используется стентирование. Это решает серьезные задачи, не прибегая к «большой хирургии», малоинвазивным способом.

Паллиативное лечение распространённого рака пищевода
В этой ситуации на передний план выходит полная невозможность питания через практически закрытый опухолью пищевод. Часто прибегают к расширению — реканализации или установке специального стента в пищеводе. Стенты обязательны при соединении пищевода и трахеи или бронхов соустьем — опухолевым свищом, что предотвращает заброс пищи в дыхательное дерево и уберегает от пневмонии. В некоторых случаях во время эндоскопии опухоль частично разрушают лазером, используя фотодинамическую терапию. Вариантов лечения рака пищевода достаточно, надо вовремя и умело их использовать.
Стентирование при раке пищевода
В последние годы врачи Юсуповской больницы большое внимание уделяют малоинвазивной хирургии рака пищевода. Это связано с тем, что большинство пациентов, поступающих в онкологические учреждения, страдают далеко зашедшей дисфагией (нарушением глотания). Более 70 % больных, поступающих в клинику онкологии, по поводу рака пищевода, не подлежат хирургическому лечению. Часто онкологи не имеют возможности выполнить радикальную операцию по причине распространённости опухолевого процесса – обширного лимфогенного и гематогенного метастазирования и сопутствующих заболеваний. Хирурги формируют больным раком пищевода питательные гастростомы или еюностомы, что в значительной степени подрывает социальный статус людей, создаёт физический и психологический дискомфорт.
Стентирование пищевода при раке пищевода позволяет улучшить качество жизни пациента и увеличить её продолжительность. В Юсуповской больнице созданы все условия для лечения больных раком пищевода:
- комфортные палаты;
- современное диагностическое оборудование ведущих фирм мира;
- квалифицированный персонал, знающий особенности пациентов со злокачественными новообразованиями;
- инновационные методы лечения, в том числе и эндопротезирование пищевода.
Это позволило улучшить результаты лечения больных раком пищевода. У пациентов, которым выполнено стентирование пищевода при раке пищевода, продолжительность жизни увеличивается.
Показания к стентированию пищевода
Врачи пациентам, у которых выявлено злокачественное новообразование на поздней стадии, устанавливают стент для пищевода. Цена зависит от вида импланта и фирмы-производителя. Стентирование пищевода является бескровной, щадящей операцией, позволяющей восстановить проходимость пищевода на более или менее протяжённом участке. Пищевод – орган, представляющий из себя полую трубку. Ввиду различных причин он может утратить свою проходимость. Это приводит к нарушению продвижения пищи к желудку. При локальном сужении пищевода врачи для восстановления его проходимости используют специальное приспособление – стент.
Установка стента в пищевод производится при наличии следующих показаний:
- химический, лучевой или термический ожог пищевода;
- сдавливание пищевода извне новообразованиями грудой клетки;
- сужение пищевода, вызванное неоперабельными злокачественными опухолями, расположенными в органе;
- рецидив рака пищевода или злокачественного новообразования верхней части желудка.
Стентирование также производится после хирургического лечения с последующим сужением просвета пищевода в области операции.
Методика стентирования пищевода при раке
Для стентирования пищевода врачи используют стенты, изготовленные из никелевых или титановых сплавов. Протез с внутренней или наружной стороны покрывают биологически инертной плёнкой. Она может быть силиконовой, полиэтиленовой, полиэстерной или фторопластной. Длина стента от 6 до 17 см, его диаметр в расправленном виде может варьировать от 18 до 25см.
Онкологи Юсуповской больницы используют разные виды имплантов для стентирования при раке пищевода:
- протез с противорефлюксным клапаном;
- имплант максимально возможной гибкости;
- стент, оснащённый нитью для извлечения приспособления.
Установку стента производят либо с предварительным расширением пищевода, либо без дилатации. Если установку импланта производят без предварительного расширения поражённого участка пищевода с помощью баллона и после него во время рентгенологического исследования, доставочное устройство стента не применяют. Следующий метод эндопротезирования пищевода основан на стентировании с помощью эндоскопа под рентгенологическим контролем. Показанием к применению этого метода является неправильная форма поражённого опухолью участка пищевода. Врачи редко выполняют стентирование под мануальным контролем.
Прежде чем установить в пищевод стент, врач проводит разметку участка, где он должен раскрыться. Для этого используют несколько методов:
- инъекция рентгеноконтрастного вещества под слизистую оболочку участка, на котором планируется стентирование;
- крепление под слизистую оболочку танталовых клип;
- фиксация контрастных меток, которые видны во время рентгенологического исследования, на коже грудной клетки в области проекции планируемой установки стента;
- контроль ближнего конца импланта с помощью эндоскопа.
Стент при помощи специального проводника в сложенном состоянии подводят к месту сужения пищевода. Используя специальное устройство, конструкцию расправляют, проводник извлекают. Полное расправление стента происходит через 2-5 дней после установки.
Осложнения после стентирования пищевода
Установка стента в пищевод возвращает пациента к нормальной жизни, позволяет полностью восстановить процесс приёма пищи естественным путём. Иногда это способствует полному выздоровлению пациента от основного заболевания. После стентирования пищевода по поводу запущенной стадии рака, операция существенно уменьшает страдания пациента и родственников, которые ухаживают за ним.
В послеоперационном периоде большинство пациентов после эндопротезирования пищевода чувствуют себя хорошо. При выраженном болевом синдроме врачи назначают анальгетики. Если после установки стента в пищевод он смещается, имплант подтягивают за нитку и устанавливают в проекции сужения. При значительной миграции стента его устанавливают повторно.
Если рост опухоли продолжается выше места установки стента, у пациентов может развиться повторная дисфагия. Им устанавливают второй покрытый стент с частичным наложением на первый. В позднем послеоперационном периоде существует риск обрыва и миграции в желудок отдалённого сегмента стента. Причиной нарушения целостности импланта является агрессивное воздействие соляной кислоты. В этом случаи врачи с помощью эндоскопа удаляют фрагменты стента биопсийными щипцами и устанавливают новый имплант.
При эндопротезировании нижнегрудного и абдоминального отделов пищевода у пациентов развивается рефлюкс-эзофагит. Тогда пациентам устанавливают протез с антирефлюксным карманом. В месте расширения пищевода перед областью стеноза может образоваться карман с застоем пищи. Онкологи в этом случае производят повторную замену стента с конусовидным расширением приближенного к опухоли конца. К редким осложнениям стентирования относится пищеводное кровотечение, пневмония.
Получите консультацию позвонив по телефону Юсуповской больницы, где врачи применяют различные методики стентирования пищевода.
Читайте также:

