Забор материала на вирусологическое исследование
Обновлено: 04.05.2024
Порядок забора биологического материала из полости носа и ротоглотки
1. Возьмите пробирку в левую руку, правой рукой откройте ее.
2. Возьмите в правую руку пластиковый зонд с ватным тампоном.
3. Легким вращательным движением введите тампон в один носовой ход, затем в другой на глубину 1,5−2 сантиметра, плотно прикасаясь к их стенкам и перегородке носа.
4. Осторожно, не касаясь краев и наружной поверхности пробирки, введите в нее зонд.
5. Отломите конец зонда по метке так, чтобы он позволил плотно закрыть крышку пробирки.
6. Сбросьте отломанную часть зонда в контейнер для отходов класса В.
7. Плотно закройте пробирку.
8. Поставьте пробирку с зондом в штатив.
9. Возьмите вторую пробирку в левую руку, правой рукой откройте ее.
10. Возьмите в правую руку пластиковый зонд с ватным тампоном.
11. Попросите пациента открыть рот и немного запрокинуть голову назад.
12. Введите зонд в полость рта, не касаясь зубов, языка, слизистой оболочки щек, твёрдого и мягкого неба.
13. Легким вращательным движением проверните тампоном по задней стенке глотки.
14. Проведите тампоном по небным дужкам и миндалинам в следующей последовательности: правая небная дужка, правая миндалина, язычок, левая небная дужка, левая миндалина.
15. Извлеките зонд из ротовой полости, не касаясь слизистой оболочки рта, зубов, языка.
16. Осторожно, не касаясь краёв и наружной поверхности пробирки, введите в нее зонд.
17. Отломите конец зонда по метке так, чтобы он позволил плотно закрыть крышку пробирки.
18. Сбросьте отломанную часть зонда в контейнер для отходов класса В.
19. Плотно закройте пробирку.
20. Загерметизируйте пробирки. Герметизация закрытого верхнего конца пробирки вместе с крышкой осуществляется различными пластификаторами, например, парафин или парафилм.
Отбор и транспортировка проб биологического материала для исследований методом ПЦР на респираторные вирусы, включая высокопатогенные штаммы вируса гриппа А (H1N1) pdm09
Сбор клинического материала, упаковку и доставку проб осуществляет медицинский работник ЛПО, согласно МР 01/7161-9-34 «Организация и проведение лабораторной диагностики заболеваний, вызванных высокопатогенными штаммами вируса гриппа А (H1N1), у людей». Обязательно наличие сопроводительной информации по форме направления на микробиологические исследования. В направлении на исследование необходимо дополнительно указывать лиц, страдающих сахарным диабетом, ожирением, ВИЧ инфекцией, сердечно-сосудистой и легочной патологией, беременных.
Для забора и доставки материала лечебно-профилактические организации края должны быть обеспечены одноразовыми пластиковыми пробирками и флаконами с завинчивающимися крышками, зондами-тампонами в индивидуальной упаковке или пробирке (тубсере). Не допускается забирать материал в агаризованные транспортные системы среды (Эймса, Кери-Блейр, Стюарта).
Правила сбора клинического (секционного) материала
Сбор клинического материала и его упаковку осуществляет медицинский работник лечебно-профилактической организации, обученный требованиям и правилам биологической безопасности при работе и сборе материала, подозрительного на зараженность высокопатогенными штаммами вируса гриппа A(H1N1). Забор производят в стерильные одноразовые пластиковые пробирки, контейнеры, стерильными инструментами. Все виды работ проводят с соблюдением противоэпидемического режима, в строгом соответствии с требованиями действующих нормативно-методических документов.
Упаковка, маркирование, условия хранения и транспортирования материала для проведения лабораторной диагностики заболеваний, должны соответствовать требованиям действующих нормативно методических документов.
Для исследования забирают следующие виды клинического материала:
- мазки из полости носа (обязательный материал для ОТ-ПЦР-анализа);
- мазки из ротоглотки (обязательный материал для ОТ-ПЦР-анализа);
- носоглоточное отделяемое (для выделения вируса, ОТ-ПЦР-анализа);
- мокрота (при подозрении на вирусную или вирусно-бактериальную пневмонию).
Целесообразно также включать в исследование аспираты из трахеи, бронхоальвеолярный лаваж и биоптаты легких при возможности их забора. Данные процедуры осуществляет подготовленный медицинский персонал в соответствии с действующими нормативно-методическими документами (МР от 24.05.09 № 01/7161-9-34, МУК 4.2.3115-13).
Перечисленные выше процедуры по забору клинического материала обученный медицинский персонал осуществляет в средствах индивидуальной защиты органов дыхания (респиратор типа ШБ-1 или РБ «Лепесток-200»), защитных очках или щитках для защиты лица, бахилах, двойными резиновыми перчатками. После процедуры отбора материала перчатки обрабатываются растворами дезинфицирующих средств, руки после снятия перчаток обрабатываются антисептиками в соответствии с действующими нормативно-методическими документами.
Выбор времени забора клинического материала очень важен, так как наиболее высокое содержание вируса в дыхательных органах человека регистрируется в течение первых четырех дней после появления признаков заболевания. Образцы должны быть собраны в течение 3 суток после появления клинических признаков.
Для постмортальной диагностики используют аутоптаты легких, трахеи и селезенки.
От одного больного должно забираться не менее двух видов клинического материала. Обязательно следует забирать мазки из полости носа, мазки из ротоглотки. Каждый образец материала помещают в отдельную транспортную емкость.
Упаковка и транспортирование образцов.
Все материалы, доставляемые в лабораторию, должны быть герметично упакованы в соответствии с действующими нормативно-методическими документами:
1) в транспортную емкость (плотно закрывающиеся пластмассовые пробирки или флаконы с завинчивающимися крышками, проверенные на герметичность); плотно закрытый верхний конец транспортной емкости вместе с крышкой герметизируют различными пластификаторами (парафин, лейкопластырь и др., но не скотч), емкость маркируют;
2) в плотный полиэтиленовый пакет подходящего размера с ватой (или другим гигроскопичным материалом) в количестве достаточном для адсорбции всего образца в случае его утечки; полиэтиленовый пакет следует герметично заклеить или запаять.
В отдельный полиэтиленовый пакет вкладывают бланк заполненного направления. Пакеты с образцами от одного пациента вместе с направлением упаковывают во второй плотный полиэтиленовый пакет. Не допускается упаковывание образцов материалов от разных людей в один и тот же пакет.
Герметично закрытые полиэтиленовые пакеты помещают в термоизолирующий, плотно закрывающийся контейнер (термос, сумка-холодильник), приспособленный для транспортирования биологических материалов в вертикальном положении, исключающем переворачивание образцов.
В термоконтейнеры и термосы помещают охлаждающие элементы или пакеты со льдом. К наружной стенке термоконтейнера или термоса прикрепляют этикетку с указанием вида материала, условий транспортирования, названия пункта назначения. Сроки и условия транспортирования упакованных проб клинического материала указаны в приложении № 1. На транспортировочные термоконтейнеры должно быть нанесено название лечебной организации краской, устойчивой к действию моющих и дезинфицирующих средств.
Транспортирование проб клинического материала в лаборатории для первичного исследования материала осуществляется нарочно лицом, информированным о правилах доставки материала в соответствии с действующими нормативно-методическими документами. Термоконтейнеры, термосы после доставки материала двукратно обрабатываются дезинфицирующим раствором и возвращаются на следующий день лечебно-профилактической организации.
Забор материала на вирусологическое исследование








Забор материала из ротоглотки (для ПЦР-диагностики)
Состав набора для забора материала для диагностики гриппа1.Универсальная транспортировочная среда (или стерильный физ. р-р)
2.Зонд-тампон ПС-вискоза, индивидуальная упаковка, стерильный кат. № ИЛС 300202 (или зонд для взятия биологического материала из уретры и цервикального канала 1 шт/уп кат. №ЗГУ-ЦМ)
3.Микроцентрифужные пробирки градуированные 1,5 мл в 1 уп. 250 шт-(стерильные, Axygen, США) кат. № МСТ-150-С-S(или микроцентрифужные пробирки градуированные 2,0 мл в 1 уп.500шт. (Axygen, США) кат.№ МСТ-200-С)
Можно приобрести микроцентрифужные пробирки с разлитой транспортной средой
4. Пакеты ЗИП 2 шт.
Куда можно обращаться для приобретения расходных материалов ООО "ИнтерЛабСервис" (ИЛС) г. Москва (495) 925 05 54
ООО "ВИТА РОС" г. Ростов-на-Дону 269-93-20(21)
ЗАО " Вектор- Бест-Юг" г.Ростов-на-Дону 295-15-61; 295-13-19
"Медицина Плюс " г. Ростов-на-Дону, 255-13-21, 255-13-24 и др
(c) Управление федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека по Ростовской области, 2006—2020 г.
Если Вы не нашли необходимую информацию, попробуйте зайти на старую версию сайта
ПАМЯТКА по забору клинического материала для исследования на грипп и ОРВИ
Важнейшим этапом исследований является получение полноценного клинического материала, в котором должно содержаться большое количество эпителиальных клеток, которые выстилают глубокие отделы нижних носовых ходов и служат местом размножения вирусов.
Правила забора мазка из носа для изоляции вирусов и люминесцентной микроскопии (РИФ).
Забор материала производится в пробирку с транспортной средой, выданную специалистами вирусологической лаборатории ФБУЗ «Центр гигиены и эпидемиологии в Астраханской области».
Перед взятием материала полость носа больного очищается тампоном, освобождается от слизи, лейкоцитов, слущенных клеток (провести высмаркивание). Больной при взятии материала должен сидеть, откинувшись на спинку стула, с приподнятой кверху головой и дышать ртом. Детей до 7 лет, во избежании травм, необходимо посадить на колени ассистента, который будет удерживать руки и голову ребенка. Приподняв кончик носа левой рукой, в полость носа вводят сухой велюр-тампон (зонд на пластиковом аппликаторе) легким движением по наружной стенке носа. При этом палочку держат правой рукой как писчее перо, тампон вводят на глубину 2-3 см до нижней раковины. Затем велюр-тампон слегка опускают книзу, вводят в нижний ход под нижнюю раковину, делают легкое вращательное движение на пол-оборота и удаляют тампон вдоль наружной стенки носовой полости. Велюр-тампон сразу погружают в пробирку с 2 мл транспортной средой (палочку обломить так, чтобы флакон закрылся пробкой).
Материал необходимо доставить в вирусологическую лабораторию по адресу: ул. Н.Островского 138, 2 этаж, тел. 50-30-09 с соблюдением «холодовой цепи» в день забора материала.
При необходимости практические навыки и консультацию можно получить у сотрудников вирусологической лаборатории.
Взятие материала от больного для ОТ-ПЦР исследования.
Забор материала проводится аналогично, но в пластиковую пробирку типа Эппендорф с 0,5 мл транспортной среды, выданную специалистами лаборатории эпиднадзора за ООИ (ПЦР отделение) ФБУЗ «Центр гигиены и эпидемиологии в Астраханской области» Материал необходимо доставить в ПЦР отделение по адресу: ул. Н.Островского 138, 5 этаж, тел. 33-54-18.
Исследования проводятся с целью мониторинга за циркуляцией вирусов гриппа и ОРВИ на территории Астраханской области по распоряжению или предписанию Управления Роспотребнадзора по Астраханской области.
Образец направления на лабораторное исследование:
на группу респираторных вирусов (грипп, парагрипп, РС-, аденовирусы)
на выделение вируса гриппа/ иммунофлюоресцентное исследование -РИФ / / ПЦР исследование _______________________________________________________________
Возраст (число, месяц, год)
ЛПУ, доставившее материал, отделение
Заболевания сердечно-сосудистой системы
Заболевания легочной системы
Вакцинация против гриппа (дата, серия)
Прием противовирусных препаратов (название, сколько дней)
Прибыл из зарубежной страны (указать страну)
Дата госпитализации в ЛПУ
Дата и время забора материала
Дата и время отправки в лабораторию
Дата и время доставки материала в лабораторию
Ф.И.О. лица проводившего забор клинического материала
(c) Управление Федеральной службы по надзору
в сфере защиты прав потребителей и благополучия
человека по Астраханской области, 2006-2021 г.
Забор материала на вирусологическое исследование
Методы обнаружения вирусов. Лабораторные методы при диагностике вирусных инфекций. Забор материала для выявления вирусов. Культуры клеток для выявления вирусов.
Лабораторные методы при диагностике вирусных инфекций включают:
• выделение и идентификацию возбудителя;
• обнаружение и определение титров противовирусных AT;
• обнаружение Аг вирусов в образцах исследуемого материала;
• микроскопическое исследование препаратов исследуемого материала.
Забор материала для выявления вирусов
При заборе материала для исследований необходимо выполнять следующие условия:
• образцы следует отбирать как можно раньше либо с учётом ритма циркуляции возбудителя;
• материал следует отбирать в объёме, достаточном для всего комплекса исследований;
• образцы следует доставлять в лабораторию незамедлительно (!), при относительно кратковременной транспортировке (не более 5 сут) образцы сохраняют на льду, при более длительной — при температуре -50 С.
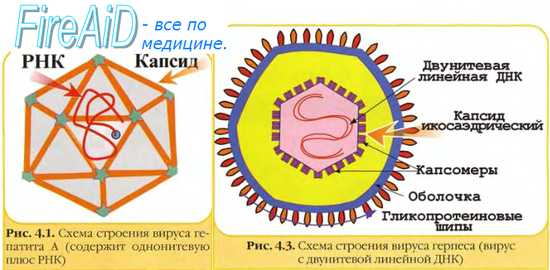
Выделение и культивирование вирусов
Выделение и идентификация возбудителя — золотой стандарт в диагностике вирусных инфекций.
Культуры клеток для выявления вирусов
Вирусы размножаются только в живых клетках, и выделение возбудителя в заражённой культуре клеток — один из основных методов диагностики вирусных инфекций. Поскольку большинство патогенных вирусов отличает тканевая и типовая специфичность, то почти к каждому вирусу можно подобрать соответствующие клеточные или тканевые чультуры, а также создать стандартные условия культивирования (наличие клеток одного типа). Размножение вируса обеспечивают чувствительные (пермиссивные) клетки. Поэтому при выделении неизвестного возбудителя проводят одномоментное заражение 3
4 культур клеток, предполагая, что одна из них может оказаться пермиссивной. Культуры клеток получают диспергированием соответствующих органов и тканей, но чаще используют эмбриональные ткани (человека и животных) либо трансформированные опухолевые клетки. При помещении на соответствующую плоскую поверхность клеточные культуры обычно растут в виде монослоя. Первично-трипсинизированные культуры. Суспензии клеток получают гомогенизированием соответствующих тканей, предварительно обработанных трипсином. Культуры часто представлены клетками смешанного типа и не подлежат повторному культивированию. Жизнеспособность таких культур составляет 2-3 нед.
Полуперевиваемые линии клеток представлены диплоидными клетками человека и животных. Культуры ограниченно пригодны к повторному диспергированию и росту (как правило, не более 20-30 пересевов), сохраняя при этом жизнеспособность и не подвергаясь спонтанной трансформации.
Перевиваемые линии клеток (гетероплоидные культуры) представлены клетками, подвергнутыми длительному культивированию и спонтанным трансформациям. Культуры способны к многократному диспергированию и перевиванию. Работа с ними менее трудоёмка по сравнению с приготовлениями первичных культур; перевиваемые клетки относительно одинаковы по своей морфологии и стабильны по свойствам.
Биологический материал со слизистых оболочек верхних дыхательных путей
Сбор материала для культуральных исследований и микроскопии необходимо проводить до назначения специфической противомикробной терапии. Несоблюдение данного условия может привести к ложноотрицательному результату исследования. материал берут натощак или через 3-4 ч после еды. Для более полного открытия глоточного отверстия рекомендуется по время забора материала надавливать шпателем на корень языка. Важно, чтобы при извлечении тампона он не касался зубов, щек, языка. Для сбора мазков из носоглотки и ротоглотки используются стерильные зонды, которые после сбора материала погружают в контейнеры с транспортной средой, обеспечивающей стабильность и сохранение ростовых свойств микроорганизмов. Тип зондов, состав транспортных сред, методику сбора, а также условия хранения и транспортирования клинического материала следует уточнить в инструкции к используемым реагентам.
Хранение образцов
- Для культуральных исследований и микроскопии – при температуре 2–8°С не более 24 ч.
- Для выявления РНК/ДНК:
- при температуре 2–8°С – в течение 3 сут.;
- при температуре минус 16–20°С – до 3 мес.;
- длительно при температуре не выше минус 68°С.
Допускается лишь однократное замораживание–оттаивание материала.
Мазки со слизистой носоглотки и ротоглотки для выявления РНК/ДНК – рекомендуется совмещать мазки со слизистой носоглотки и ротоглотки в одной пробирке. Для этого сначала берут мазки разными зондами со слизистой нижнего носового хода, а затем из ротоглотки, при этом рабочие концы зондов после взятия мазков у пациента помещаются в одну пробирку с 500 мкл транспортной среды для хранения и транспортировки респираторных мазков, и исследуются как один образец. Материал берется после полоскания полости ротоглотки кипяченой водой комнатной температуры. Если полость носа заполнена слизью, перед процедурой рекомендуется провести высмаркивание. В течение шести часов перед процедурой нельзя использовать медикаменты, орошающие носоглотку или ротоглотку и препараты для рассасывания во рту. Мазки со слизистой носоглотки берут сухим стерильным назофарингеальным велюр-тампоном на пластиковом аппликаторе. Зонд вводят легким движением по наружной стенке носа на глубину 2–3 см до нижней раковины, слегка опускают книзу, вводят в нижний носовой ход под нижнюю носовую раковину до носоглотки, делают вращательное движение и удаляют вдоль наружной стенки носа. Общая глубина введения зонда должна составлять примерно половину расстояния от ноздри до ушного отверстия (3–4 см для детей и 5–6 см для взрослых). После забора материала конец зонда с тампоном опускают в стерильную одноразовую пробирку с 500 мкл транспортной среды для хранения и транспортировки респираторных мазков до места слома, при этом гибкая часть зонда сворачивается спиралью, далее, прикрывая сверху пробирку крышкой, рукоятку зонда опускают вниз, добиваясь полного отламывания верхней части зонда. Пробирку герметично закрывают. Мазки из ротоглотки берут сухими стерильными зондами из полистирола с вискозными тампонами вращательными движениями с поверхности миндалин, небных дужек и задней стенки ротоглотки, аккуратно прижимая язык пациента шпателем. После забора материала рабочую часть зонда с тампоном помещают в стерильную одноразовую пробирку с 500 мкл транспортной среды и зондом с мазком из носоглотки. Конец зонда с тампоном отламывают, придерживая крышкой пробирки с расчетом, чтобы он позволил плотно закрыть пробирку.
Смыв из ротоглотки для диагностики эпидемического паротита (выделение РНК). Перед взятием смывов из ротоглотки проводят предварительное полоскание полости рта водой. После этого проводят тщательное полоскание ротоглотки (в течение 10-15 с) 25-40 мл изотонического раствора натрия хлорида. Жидкость собирают через стерильную воронку в стерильный флакон на 50 мл.
Хранение образцов
- при комнатной температуре – в течение 6 ч.
- при температуре от 2°С до 8°С – в течение 3 суток
- при температуре минус 20°С – в течение 1 недели
- при температуре минус 70°С – длительно
Мазки из ротоглотки и носа для диагностики дифтерии, пневмококковой, стафилококковой, стрептококковой инфекции (культуральные исследования) – для взятия материала используется сухой стерильный ватный тампон, вмонтированный в пробку пробирки или готовые транспортные среды, отдельным тампоном из ротоглотки и из носа. Взятие мазков осуществляют натощак или не ранее двух часов после еды, не касаясь тампоном языка, внутренних поверхностей щек и зубов.
Мазки из ротоглотки и носа для диагностики менингококковой инфекции (культуральные исследования) – тампон вводят через ротовую полость ватным концом кверху за мягкое небо в носоглотку и проводят 2–3 раза по задней стенке. При извлечении из ротоглотки тампон не должен касаться окружающих тканей (зубы, слизистая щек, язык, небный язычок). После извлечения тампона содержащуюся на нем слизь засевают на чашки (сывороточный агар и сывороточный агар с линкомицином) или помещают в транспортную среду для немедленной доставки в лабораторию. Допускается применение коммерческих питательных транспортных сред разрешенных к применению в Российской Федерации в установленном порядке.
Мазки из носоглотки для диагностики гриппа (культуральные исследования) собирают стерильными зондами с вискозными тампонами из нижнего носового хода. Зонд с тампоном вводят легким движением по наружной стенке носа на глубину 2–3 см до нижней раковины, слегка опускают книзу, вводят в нижний носовой ход глубоко, делают вращательное движение и удаляют вдоль наружной стенки носа. Общая глубина введения зонда должна составлять примерно половину расстояния от ноздри до ушного отверстия (3–4 см для детей и 5–6 см для взрослых). После взятия материала тампон, не нарушая стерильности, помещают в пробирку с 2,0–5,0 мл вирусологической транспортной среды. Материал хранят в течение 24 ч при температуре 2–8°С, более длительно – при температуре не выше минус 16°С.
Мазки из носоглотки для диагностики коклюша (культуральные исследования) собирают стерильными зонд-тампонами с вискозным наконечником на алюминиевой основе, вмонтированный в пробку и пробирку с транспортной средой AMIES с активированным углем. Зонд извлекают из упаковки, вводят через носовые ходы и удерживают в носоглотке в течение 10 сек, чтобы он пропитался отделяемым слизистой носоглотки. После этого тампон извлекают, делая упор на боковую стенку носа, и немедленно помещают в пробирку с транспортной средой AMIES с активированным углем. Собранный материал необходимо исследовать в день получения (в исключительных случаях – хранить в холодильнике при температуре 2–8°С не более 12 ч).
Заднеглоточные мазки для диагностики коклюша (культуральные исследования) собирают стерильным зонд-тампоном с вискозным наконечником на алюминиевой основе, вмонтированным в пробку, вносят в пробирку с транспортной средой AMIES с активированным углем. Целесообразно использовать готовые комплекты. Зонд извлекают из упаковки, пробирку со средой вскрывают, конец зонда (на расстоянии 2 см от конца с тампоном) помещают в пробирку и изгибают под углом 135°, делая упор на внутренний край пробирки, и извлекают из пробирки. Аккуратно прижимая язык пациента шпателем, вводят изогнутый тампон в ротовую полость ниже язычка и собирают материал с задней стенки глотки, не задевая язык, слизистую оболочку щек и миндалины. Зонд с биоматериалом помещают в пробирку со средой AMIES, следя за тем, чтобы пробка, в которую вмонтирован тампон, плотно закрывала пробирку. Пробирки с транспортной средой AMIES до использования хранят при комнатной температуре. После взятия материала тампон, не нарушая стерильности, помещают в пробирку с 2,0–5,0 мл вирусологической транспортной среды. Собранный материал необходимо исследовать в день получения (в исключительных случаях – хранить в холодильнике при температуре 2–8°С не более 12 ч).
Метод «кашлевых пластинок» для диагностики коклюша (культуральные исследования): чашку со средой (Борде-Жангу или КУА с антибиотиками и добавлением 20% или 10% крови животных соответственно), хранящуюся при температуре 2–8°С, выдерживают при комнатной температуре, подносят на расстоянии 8–10 см ко рту кашляющего ребенка и удерживают ее в течение нескольких секунд (6–8 кашлевых толчков). Собранный материал необходимо исследовать в день получения (в исключительных случаях – хранить при температуре 2–8°С не более 12 ч).
Мазки со слизистой носоглотки для диагностики кори (культуральные и исследования, выделение РНК) – для взятия материала используют стерильный ватный тампон, которым протирают слизистую оболочку носоглотки с достаточным усилием, чтобы снять часть эпителиальных клеток. Тампоны помещают в маркированные стерильные пробирки с завинчивающимися крышками, в которых содержится 2–3 мл транспортной среды для вирусов. Если образец не может быть доставлен в вирусологическую лабораторию в течение 48 часов при температуре 4–8°С, пробирку с тампоном следует энергично встряхнуть так, чтобы смыть клетки, а затем извлечь тампон. Смывы центрифугируют при температуре 4°С при 500g (1500 об./мин) в течение 5 минут, затем осадок ресуспендируют в 2 мл питательной среды для клеточных культур.
Ресуспендированный осадок и надосадочную жидкость хранят раздельно при температуре –70°С и транспортируют в лабораторию на сухом льду в герметично закрытых флаконах, чтобы избежать попадания в них углекислоты.
Мазки из носоглотки для обнаружения антигенов внутриклеточных патогенов собирают стерильными зондами с вискозными тампонами из нижнего носового хода. Зонд с тампоном вводят легким движением по наружной стенке носа на глубину 2–3 см до нижней раковины. Затем зонд слегка опускают книзу, вводят в нижний носовой ход под нижнюю носовую раковину глубоко (вплоть до слез у пациента), делают вращательное движение и удаляют вдоль наружной стенки носа. После взятия материала тампон помещают в пробирку с 3 мл 0,1 моль/л фосфатно-солевого буферного раствора. Для получения суспензии клеток тампон в пробирке тщательно отжимают о стенки пробирки, тампон удаляют, пробирку закрывают. Проводят центрифугирование в течение 5 мин при 3000 об/мин для осаждения клеток. Надосадочную жидкость осторожно удаляют, а осадок клеток ресуспендируют в нескольких каплях фосфатно-солевого буферного раствора и наносят на предметные стекла (не менее 3 шт.) раздельными каплями. Препарат высушивают и фиксируют 10 мин в охлажденном до 2–8°С химически чистом ацетоне. Фиксированные предметные стекла хранят при температуре 2–8°С не более 6–7 дней.
Диагностика коронавируса COVID-19
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Определение
Новая коронавирусная инфекция COVID-19 – это острое инфекционное заболевание, относящееся к группе ОРВИ (острых респираторных вирусных инфекций). Его вызывает новый коронавирус SARS-CoV-2.
Основным источником инфекции является больной человек, в том числе находящийся в инкубационном периоде заболевания (между моментом заражения и появлением первых жалоб).
Наибольшую опасность для окружающих человек представляет в последние два дня инкубационного периода (больной еще не знает, что болен, но уже выделяет вирус) и в первые дни болезни (поскольку выделяет максимальное количество вируса).Пути передачи вируса
Передача инфекции осуществляется воздушно-капельным и контактным путями. Воздушно-капельный путь считается основным и реализуется при кашле, чихании и разговоре на близком (менее 2 метров) расстоянии. Контактным путем можно заразиться через рукопожатия, объятия и поцелуи, а также через поверхности и предметы, пищевые продукты, обсемененные вирусом.
Жалобы при COVID-19 неспецифичны и встречаются при других ОРВИ. В большинстве случаев болезнь протекает нетяжело. Нередко отмечается и вовсе бессимптомное течение: человек чувствует себя хорошо, не предъявляет никаких жалоб, а о перенесенной болезни узнает случайно, сдав анализы.
- Легкое течение (около 80% заболевших).
- Температура тела до 38°C, кашель (чаще сухой, но может быть и с мокротой), общая слабость, боли в горле; возможно, снижение обоняния и вкуса, расстройство стула, различные кожные высыпания.
- Среднетяжелое течение.
- Температура тела выше 38°C.
- Частота дыхания более 22/мин.
- Одышка – ощущение нехватки воздуха, сопровождающееся изменением частоты, глубины и ритма дыхания при обычных физических нагрузках.
- Изменения на КТ (компьютерной томографии) органов грудной клетки, типичные для вирусного поражения (объем поражения минимальный или средний; КТ 1-2).
- Сатурация кислорода (SpO2) – насыщение крови кислородом менее 95%.
- СРБ (С-реактивный белок) сыворотки крови более 10 мг/л.
- Тяжелое течение.
- Частота дыхания более 30/мин.
- SpO2 менее 93%.
- Снижение уровня сознания или возбуждение.
- Нестабильная гемодинамика (снижение артериального давления менее 90/60 мм рт. ст., уменьшение объема выделяемой мочи).
- Изменения в легких на КТ органов грудной клетки, типичные для вирусного поражения (объем поражения значительный или субтотальный; КТ 3-4).
- Изменения ряда лабораторных показателей, определяемых в условиях отделения интенсивной терапии.
- Крайне тяжелое течение – множественные тяжелейшие поражения органов и систем с необходимостью респираторной поддержки (инвазивной вентиляции легких).
- Изменения в легких при КТ, типичные для вирусного поражения критической степени (объем поражения значительный или субтотальный; КТ 4).
- Обнаружение РНК SARS-CoV-2 методом ПЦР;
- Обнаружение вирусных антигенов (экспресс-диагностика).
- Обнаружение антител IgG и IgM к коронавирусу – качественный (есть или нет антитела) и количественный (сколько антител) методы.
- Обнаружение антител IgG и IgM к коронавирусу (экспресс-диагностика).
Их достоинства – быстрое (в течение 20-30 минут) получение результата, возможность использования в домашних условиях. Недостаток – не слишком высокая точность: из-за невысокой чувствительности тесты не всегда могут определить пациентов с новой коронавирусной болезнью (не определяют примерно каждого четвертого). Если тест положительный, то это практически всегда верно. Отрицательный тест не исключает наличие болезни. Экспресс-методы могут использоваться в первичной диагностике для определения дальнейшей тактики обследования.
-
Клинический (общий) анализ крови, С-реактивный белок, прокальцитонин – для исключения присоединения бактериальной инфекции.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
До 1 рабочего дня № 43 Маркёры воспаленияС-реактивный белок – белок острой фазы, чувствительный индикатор повреждения тканей при воспалении, некрозе, травме. Синонимы: Анализ крови на СРБ; С-реактивный белок сыворотки крови. C-reactive Protein (CRP), quantitative; C-reactive protein test; CRP test. Краткое описание опред.
До 1 рабочего дня № 1700 Маркёры воспаленияСинонимы: Прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого аналита Прокальцитонин Тест применяют для дифференциации бактериальных инфекций от других причин воспаления, оценки тяжести бактериальной инфекции, уточнения показаний к началу или прекращению тера.
До 1 рабочего дня № 164 Коагулологические исследования (коагулограмма)Синонимы: Фрагмент расщепления фибрина. D-dimer, Fragment D-dimer, Fibrin degradation fragment. Краткая характеристика определяемого вещества D-димер D-димер представляет собой растворимый продукт расщепления поперечно-сшитого фибрина. Генерация D-димера требует последовательной активност.
До 1 рабочего дня № 3320 COVID-19Запись на исследование В случае получения положительного или сомнительного результата на COVID-19 и при необходимости проведения подтверждающего тестирования образец биоматериала может быть направлен в уполномоченную референс-лабораторию в соответствии с СП 3.1.3597-20, в связи с чем .
До 2 рабочих днейСрок выполнения исследования на выявление РНК SARS-CoV-2 в лабораториях медицинских организаций не должен превышать 48 часов с момента получения биологического материала. Если отбор проводится не в лабораторном центре, необходимо учитывать время доставки проб до лаборатории. Срок выполнения исследований в референтной лаборатории – не более 48 часов с момента доставки образца.
Взятие мазка методом ПЦР для обнаружения РНК SARS-CoV-2 проводится:
- всем лицам с признаками ОРВИ;
- пациентам с диагнозом «внебольничная пневмония»;
- лицам, контактировавшим с больным COVID-19, при появлении симптомов, не исключающих COVID-19;
- работникам медицинских организаций, имеющим риск инфицирования при профессиональной деятельности, до появления IgG – 1 раз в неделю; при появлении симптомов, не исключающих COVID-19, – немедленно;
- прибывшим на территорию Российской Федерации из-за границы;
- взрослым и детям из организованных коллективов - интернатов, детских домов, пансионатов для пожилых и т.д. при появлении респираторных симптомов.
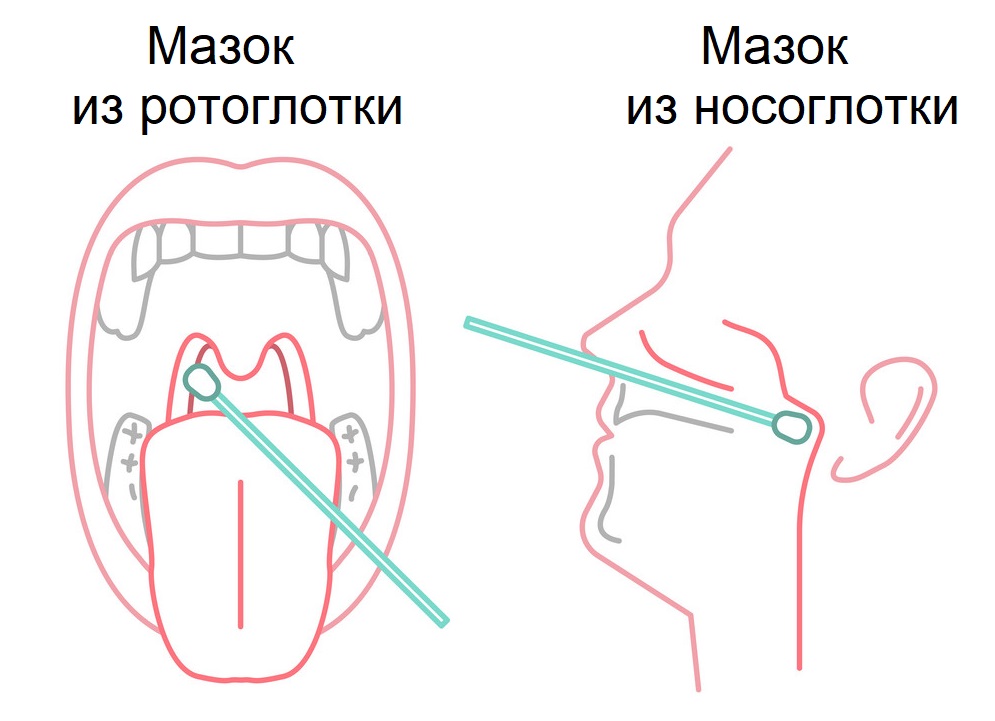
Пациенту за 3-4 часа до взятия мазка нельзя есть, пить, чистить зубы, полоскать рот и горло, использовать спрей-освежитель для ротовой полости, жевать жевательную резинку, курить. Кроме того, нельзя промывать нос, использовать спреи, капли, мази для носа. Это позволит сохранить для исследования максимально возможное число пораженных вирусом клеток эпителия (наружного слоя) верхних дыхательных путей.
Интерпретация результатов
«Обнаружено» – результат говорит о наличии РНК вируса в пробе биоматериала пациента, то есть человек инфицирован коронавирусом, заразен для окружающих.
В случае получения в лаборатории положительного теста результат выдается как «первично положительный», а биоматериал передается для проведения подтверждающего теста в референсный центр Роспотребнадзора.Результат первичного тестирования может быть как подтвержден, так и не подтвержден референсным центром. При получении первично-положительного результата пациенту необходимо соблюдать режим самоизоляции до получения результата подтверждающего теста. Формулировка «обнаружено» в результате подтверждающего теста означает, что исследование пробы пациента выполнено дважды, первично положительный результат подтвержден дополнительным исследованием в референсном центре. При получении окончательного результата «обнаружено» заболевшему предписывается соблюдать режим самоизоляции и обратиться к врачу.
«Не обнаружено» – результат говорит об отсутствии РНК вируса в пробе пациента, значит в организме человека нет коронавируса.
К сожалению, ПЦР-диагностика иногда может давать ошибочные результаты. Причины ложноотрицательных результатов (человек болен COVID-19, а результат теста отрицательный):
- количество вируса в образце меньше порога чувствительности тест-системы из-за некорректной подготовки пациента к исследованию или из-за небольшого количества вируса в организме (низкая вирусная нагрузка), например, при бессимптомном течении или в период выздоровления;
- некорректное взятие мазка – например, только из зева или только из носа, погрешности в технике забора материала;
- нарушение рекомендованного срока хранения взятого образца;
- ненадежная система идентификации образцов, что ведет к получению чужого результата.
Антитела класса М (IgМ) к SARS-CoV-2 появляются, как правило, на 7-10 день болезни. Они могут сохраняться в организме человека до 2-3 месяцев. Поэтому их обнаружение говорит о текущей или недавно перенесенной инфекции.
Антитела класса G (IgG) к SARS-CoV-2 обнаруживают обычно через 10-14 дней после начала болезни. Выявление IgG-антител к возбудителю COVID-19 свидетельствует, что человек выздоравливает или уже переболел коронавирусной инфекцией. Длительность их сохранения в организме на сегодняшний день точно неизвестна.
Тестирование на антитела к вирусу SARS-Cov-2 рекомендуется использовать в следующих случаях:
- в качестве дополнительного метода диагностики острой инфекции (не ранее 7-го дня болезни для IgM, не ранее 10-14-го дня болезни для IgG) или при невозможности по какой-либо причине исследования мазков;
- для выявления лиц с бессимптомной формой инфекции;
- для установления факта перенесенной ранее инфекции при обследовании групп риска и проведении массового обследования населения для оценки уровня популяционного иммунитета;
- для отбора потенциальных доноров иммунокомпетентной (антиковидной) плазмы.
Для оценки иммунитета после вакцинации имеет значение только выявление определенных IgG – антител к спайковому (S) белку SARS-CoV-2 (качественный).
№ 1652 COVID-19Синонимы: Выявление IgG к спайковому (S) белку SARS-CoV-2 (качественный анализ) после COVID-19 и для оценки эффективности вакцинации (вакцинным препаратом на основе RBD-домена Spike вируса SARS-CoV-2, например, «Спутник V»). IgG anti-spike protein S to assess protective immunity .
До 3 рабочих днейЭтот анализ выявляет наличие или отсутствие антител. При повторном выполнении количественного анализа можно оценивать устойчивость иммунного ответа по динамике уровня этих антител. Тест на антитела к N-белку не информативен для оценки поствакцинального иммунитета.
Объем сроки и кратность исследований при новой коронавирусной болезни COVID-19
Объем, сроки и кратность лабораторных исследований зависят от степени тяжести заболевания. Легкое течение заболевания с наблюдением пациента в амбулаторных условиях, как правило, не требует дополнительных лабораторных исследований. В случае среднетяжелого и тяжелого течения выполняются следующие исследования:
Клинический анализ крови: общий анализ, лейкоформула, СОЭ.
№ 1515 Клинический анализ кровиСинонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Забор материала на вирусологическое исследование
Важным моментом, определяющим точность проведения исследований на COVID-19 является правильный забор материала для проведения исследования. При неправильном заборе материала, его неправильном хранении или транспортировке, высок риск ложноотрицательных результатов, что может привести к ошибочной диагностике и отказу от проведения противоэпидемических мероприятий там, где они показаны.
В качестве первоначального исследования на COVID-19 рекомендуется забор и оценка мазка из верхних дыхательных путей (носоглотки (НГ)). Если произведен забор ротоглоточного мазка (РГ), он помещается в одну пробирку вместе с мазком из НГ; при этом мазок из РГ имеет меньшую значимость, чем мазок из НГ.
Процедуре забора мокроты подлежат только пациенты с влажным кашлем. Стимуляция образования мокроты не рекомендуется. Если имеются образцы из нижних дыхательных путей, они также подлежат тестированию.
При наличии клинических показаний (т.е. если пациенту проводится искусственная вентиляция лёгких), производится забор и исследование материала из нижних дыхательных путей либо производится забор бронхоальвеолярных выделений. В этом случае забор материала проводится в отделениях интенсивной терапии и реанимации. У интубированных пациентов имеет смысл проводить забор эндотрахеального аспирата или образцов, полученных в ходе бронхоальвеолярного лаважа, для проведения не только анализов на COVID-19, но и других анализов: ПЦР панель атипичных возбудителей (микоплазмы, хламидии, легионелла), панель респираторных вирусов. Также имеет смысл провести другие исследования, если этиология тяжелой пневмонии не определена: определение антигена легионелл в моче, титр антител к микоплазме, посев на туберкулез, исследования на оппортунистические патогены у больных с ослабленным иммунитетом.
Забор образцов должен быть произведен незамедлительно, как только был установлено подозрение на COVID-19, вне зависимости от того, когда появились симптомы. В момент забора образцов должен соблюдаться санитарно-эпидемический режим. Персонал должен быть обучен технике взятия мазков.
Образцы, взятые из нижних дыхательных путей
Бронхоальвеолярный лаваж, трахеальный аспират
Должно быть собрано от 2 до 3 мл образца в стерильную, герметичную емкость для забора мокроты, которая закручивается крышкой с резьбой, либо в стерильный сухой контейнер.
Пациенту следует прополоскать рот водой и после глубокого кашля откашлянуть мокроту непосредственно в стерильную, герметичную емкость для забора мокроты, которая закручивается крышкой с резьбой, либо в стерильный сухой контейнер.
Образцы, взятые из верхних дыхательных путей
Мазки из носо-/ ротоглотки
Для забора используется зонд-тампон исключительно из синтетического волокна. Не должны использоваться зонды из альгината кальция или зонды на деревянном стержне, оба из которых могут инактивировать некоторые вирусы и ингибировать полимеразную цепную реакцию (ПЦР). Зонды должны быть незамедлительно помещены в стерильные пробирки, содержащие 2–3 мл вирусной транспортной среды. Как правило, рекомендуют осуществлять забор образцов только из НГ. Когда забор производится также из РГ, он должен быть помещен при заборе вместе с мазком из НГ в одну пробирку.
Для забора образца из НГ, зонд должен быть введен в ноздрю параллельно нёбу на глубину равную расстоянию от ноздри до отверстия наружного уха. Для того, чтобы выделения впитались, зонд должен быть оставлен в месте введения на несколько секунд. Затем он должен быть медленно извлечен. При извлечении зонда сотрудник, проводящий забор, должен его вращать. При заборе образца из РГ (т.е. мазок из зева) задняя часть глотки должна быть обработана тампоном, при этом следует избегать соприкосновения с языком.
Смыв/аспират из носоглотки / аспират из полости носа
Должно быть собрано от 2 до 3 мл образца в стерильную, герметичную емкость для забора мокроты, которая закрывается крышкой, которая закручивается с помощью сеющийся на ней резьбы, либо в стерильный сухой контейнер.
Условия хранения
Образцы подлежат хранению при температуре от 2 до 8°C в течение не более 72 часов с момента забора. В случае перенесения сроков проведения исследования или доставки образцов, образцы подлежат хранению при температуре –70°C и ниже.
Доставка
Упаковка, доставка и транспортировка образцов производится в соответствии с правилами перевозки опасных грузов, разработанных для каждого конкретного государства. Образцы подлежат хранению при температуре от 2 до 8°C в течение не более 72 часов с момента забора и доставляются на следующий день в лабораторию изотермическом контейнере. Образцы, подвергнутые заморозке при температуре –70°C, должны быть помещены в контейнер с сухим льдом и доставлены на следующий день в лабораторию.
Читайте также:

