Липидный фундамент жизни биомолекула
Обновлено: 04.05.2024
Мембранные липиды. Состав биологических мембран
В состав биологических мембран входят представители трех классов веществ, обмен которых составляет основу метаболизма: это белки, жиры (липиды) и углеводы. В весовом отношении белки составляют 40–60%, согласно некоторым данным от 20% до 80%, остальное приходится на долю липидов. Часть углеводов представлена свободными олигосахаридами, а часть входит в состав сложных липидов (гликолипиды) или сложных белков (гликопротеиды). Белковый состав мембран чрезвычайно разнообразен, он в значительной мере определяет свойства мембран и их функциональную активность. Мембранные белки, как правило, почти не отличаются от растворимых по количеству входящих в них гидрофобных аминокислот. Однако эти гидрофобные аминокислоты сгруппированы в мембранных белках в ряд доменов так, что гидрофильных групп пептидной цепи недостает для их маскировки. Такие белки не активны вне гидрофобного окружения. Мембраны предоставляют им возможность стабилизировать свою структуру и нормально функционировать.
ФОСФОЛИПИДЫ, ГЛИКОЛИПИДЫ, СТЕРОИДЫ
Липиды клеточных структур эукариотических клеток представлены 3 основными группами: фосфолипиды, гликолипиды и стероиды. Распространение и свойства фосфолипидов изучены наиболее детально.
Фосфолипиды подразделяются на 2 группы:
- глицерофосфолипиды (производные фосфатидной кислоты – фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозит)
- сфингофосфолипиды (производные церамида, сфингомиелины).
Глицерофосфолипиды представляют собой производные фосфатидной кислоты, к гидроксилу фосфорной кислоты которой сложноэфирной связью присоединен радикал Х (рис. 4., табл. 1), где R1 и R2 – ацильные остатки жирных кислот, содержащих от 12 до 18 атомов углерода (как правило, четное количество). В названия фосфолипидов, потерявших одну из двух ацильных цепей, вводится приставка «лизо». Лизофосфолипиды обнаруживаются в мембранах в небольших количествах – появление этих веществ приводит к нарушению структуры бислоя и лизису клеток.

Таблица 1. Классификация фосфолипидов осуществляется по структуре полярных радикалов

Характеристика липидного состава некоторых мембран животных представлена ниже (табл. 2). Видно, что основными липидами мембран животных клеток являются глицерофосфолипиды: фосфатидилхолин и фосфатидилэтаноламин. Структура фосфатидилхолина представлена на рисунке 5. Наиболее часто встречающиеся фосфолипиды построены по единому плану, их молекулы стерически хорошо соответствуют друг другу. В то же время, огромное разнообразие фосфолипидов обеспечивается различием жирных кислот, которые входят в состав их молекул. Так, есть несколько десятков природных видов фосфатидилхолина, причем диолеилфосфатидилхолин сильно отличается по своим свойствам от дипальмитоилфосфатидилхолина.
Таблица 2. Липидный состав некоторых биологических мембран (в % от общего их количества)

Существует несколько групп фосфолипидов, отличающихся от приведенных в таблице 1 по своему строению:
2) диольные фосфолипиды
В молекуле плазмалогена первый углерод глицерина (С 1) вместо ацильной группы присоединяет альдегид (рис. 4). Радикал Х в плазмалогенах мышц представлен холином, в плазмалогенах мозга – серином или этаноламином. Диольные фосфолипиды характеризуются тем, что вместо глицерина в составе их молекул содержатся двухатомные спирты: этиленгликоль или пропандиол; это одноцепочечные липиды. По физико-химическим свойствам, например растворимости, диольные фосфолипиды напоминают лизоформы фосфолипидов. В отношении клеточных мембран они обладают более сильной разрушающей способностью, чем лизолецитин. В малых дозах они не повреждают мембрану, а лишь изменяют ее свойства, например, повышают проницаемость для небольших молекул и ионов. В больших дозах они вызывают гемолиз эритроцитов, снижают рецепцию ацетилхолина, модифицируют иммунные реакции. По-видимому, некоторые клетки используют это свойство – начинают интенсивно синтезировать диольные липиды в период быстрого роста и прекращают их образование, когда клеточный рост замедляется. Возможно, это связано с тем, что в период роста клеток их мембраны должны быть более лабильными. Они присутствуют в виде незначительных примесей в органах и тканях, характеризующихся усиленной активностью (созревание семян, регенерация печени и т.д.).
Биологическое действие диольных фосфолипидов основано на их способности модифицировать структуру мембраны. Любопытно, что существуют организмы, которым не страшны высокие концентрации диольных липидов. Клетки морских звезд, например, могут накапливать очень много диолов без вреда для их собственных мембран, хотя механизм защиты клеточных мембран от этих соединений не известен.

Жирнокислотный радикал во втором положении представлен цис-формой.
Дифосфатидилглицериды – наиболее широко распространенным представителем этой группы фосфолипидов является кардиолипин – непременный компонент митохондриальных мембран, выделенный первоначально из сердечной мышцы (рис. 6). Как упоминалось выше, кроме глицерофосфолипидов в группу фосфолипидов входят и сфинголипиды, которые можно представить как производные церамида (жирнокислотного эфира ненасыщенного аминоспирта сфингозина) и монофосфорных эфиров спиртов. В случае наиболее распространенного сфинголипида – сфингомиелина таким эфиром является фосфорилхолин (рис. 7).
Сфингомиелин содержится в больших количествах в белом веществе мозга, в миелиновых оболочках нервных стволов. Жирные кислоты, входящие в его состав, – длинноцепочечные и содержат мало двойных связей. Обычно это лигноцериновая С 24:0 и невроновая С 24:1 кислоты. В сером веществе мозга до 70% жирных кислот сфингомиелина представлено стеариновой кислотой С 18:0.


В растительных клетках холестерин не обнаружен, его заменяют фитостерины. У бактерий стероиды отсутствуют. Холестерин и его эфиры – непременные составляющие плазматических мембран клеток животных. При этом холестерин легче встраивается в мембрану, чем его эфиры (рис. 10). Молекула холестерина не содержит длинных прямых цепочек, а состоит из четырех колец; крайнее шестичленное кольцо соединено с полярной гидроксильной группой (ОН), а наиболее отдаленное от него пятичленное кольцо – с разветвленной углеводородной цепочкой из восьми атомов углерода (рис. 10).
Таким образом, молекулы холестерина, как и другие липидные молекулы, имеют полярную голову и вытянутую в длину неполярную часть. Поэтому они хорошо встраиваются в бислойные липидные структуры, образующие клеточные мембраны (рис. 10). При образовании эфиров холестерина (через гидроксильную группу) связь молекулы с бислоем ослабляется, что облегчает его вытеснение из мембраны. Особенно много холестерола содержится в наружных мембранах. Например, в плазматической мембране клеток печени холестерин составляет около 30% всех мембранных липидов.

ЖИРНЫЕ КИСЛОТЫ И ИХ ПРОСТРАНСТВЕННАЯ КОНФИГУРАЦИЯ
И фосфо-, и гликолипиды включают в состав молекул различные жирнокислотные радикалы (табл. 3). Холестерин и его аналоги также способны образовывать эфиры с разнообразными жирными кислотами. Вследствие этого свойства образующихся при этом липидов сильно варьируют. При всем разнообразии жирных кислот преобладающими для данной ткани являются обычно две или три из них.
В организме животных кроме пальмитиновой и олеиновой кислот содержатся большие количества стеариновой кислоты, а также и более высокомолекулярные кислоты с числом атомов углерода 20 и более. Как правило, они имеют четное количество атомов углерода; жирные кислоты с нечетным числом атомов встречаются только в составе цереброзидов и ганглиозидов.
Ацильные связи в молекулах природных фосфолипидов, как правило, представлены различными жирными кислотами. Они различаются как длиной цепи, так и степенью ее ненасыщенности. Если ненасыщенной является лишь одна жирнокислотная цепь, то она присоединена ко второму углеродному атому глицерина. Число двойных связей в молекулах жирных кислот колеблется от 1 до 6 и зависит от среды обитания, состава пищи, сезона и т.д. Двойные связи в жирных кислотах животного происхождения разделены метиленовой группировкой –СН=СН-СН 2 -СН=СН-.
В высших растениях присутствуют, в основном, пальмитиновая, олеиновая, и линолевая кислоты (стеариновая почти не обнаруживается), а кислоты с четным числом атомов углерода от 20 до 24 встречаются крайне редко. Жирные кислоты растений часто имеют сопряженные (конъюгированные) связи: -СН=СН-СН=СН-.
Таблица 3. Распространенные жирные кислоты в составе мембранных липидов


Углеродные связи в молекулах жирных кислот имеют различную конформацию (рис. 13). По своей структурной конфигурации насыщенные жирные кислоты сильно отличаются от ненасыщенных. Насыщенные жирные кислоты могут принимать множество конфигураций вследствие высокой свободы вращения вокруг одиночных С-С связей. Энергетически наиболее выгодной является транс-конфигурация. Ненасыщенные жирные кислоты имеют жесткую структуру, поскольку вращение вокруг двойных связей невозможно. Они существуют либо в транслибо в цис-конфигурации. Ненасыщенные жирные кислоты содержат двойные связи почти всегда в цис-конформации (Рис. 13), транс-ненасыщенные жирные кислоты в природе почти не встречаются. Исключение составляет лишь вакценовая кислота – конформационный антипод олеиновой кислоты. Температура плавления ее 44ºС, в то время как олеиновая кислота плавится при температуре 13,5ºС.
Цис-конфигурация двойной связи обусловливает изгиб цепи под углом приблизительно 30º. По этой причине цис-ненасыщенные жирные кислоты с одной двойной связью вызывают локальные возмущения бислоя. При этом длина такой цепи уменьшается, а занимаемый ею объем возрастает (рис. 13). В области локализации двойных цис-связей образуются изгибы (так называемая гошформа).
При повышении температуры тепловая подвижность жирнокислотных цепей приводит к спонтанному возникновению изгибов. Если изгибы, соответствующие гош-конформации, появляются на близлежащих участках жирнокислотной цепи, эта область может принимать вид петли или полости (кинк). В результате взаимопревращения транс- и гош-конформаций (так называемого трансгош-перехода) кинки могут «скользить» вдоль цепи, обеспечивая перемещение их содержимого поперек мембраны. Таким образом, может осуществляться диффузия захваченной воды через гидрофобный бислой.
При повышении плотности упаковки бислоя конфигурационная подвижность С-С-связей ограничивается. В таком бислое подвижность цепей ограничена согласованными колебаниями или вращательной подвижностью около точки прикрепления жирнокислотных радикалов к полярной «головке» фосфолипида. В этой ситуации в бислое наиболее предпочтительны две конформации цепи: когда вся цепь находится в транс-конфигурации или когда имеется «двойной гош», то есть изгибы, возникающие на двух соседних участках цепи вследствие образования гош-конформации, компенсируют друг друга, и вся цепь в целом не имеет изгибов.
Ввиду высокой скорости обмена мембранных липидов синтез мембранных компонентов постоянно требует большого количества жирных кислот для образования диацилглицеридов. Из них образуются фосфатидная кислота, лежащая в основе обмена фосфолипидов, или галактозилдиглицерид, приводящий к гликолипидам. Жирные кислоты включаются также в обмен сфинганиновых соединений, приводящий к образованию церамида и сфингозина. В обмен стероидов жирные кислоты вступают на последних стадиях, когда становится возможным образование эфиров холестерина и его аналогов.
Жирнокислотный состав мембранных липидов животных, в отличие от бактериальных и растительных организмов, не так своеобразен, но более вариабелен. Разные липиды обладают различным жирнокислотным составом (табл. 4). Специфика этого состава сохраняется при условии неизменности среды обитания, преимущественного характера питания и т.д.
Таблица 4. Жирнокислотный состав фосфолипидов эритроцитов человека

Поскольку все фосфолипиды являются продуктами обмена фосфатидной кислоты, можно заключить, что именно жирнокислотный состав ее молекул будет определять, какой вид фосфолипида образуется из этого предшественника в данных условиях. Но изменение состава диеты, особенно ее липидной части, быстро приводит к изменению липидного состава мембранных структур. Смена условий среды обитания, например, при переходе к зимней спячке у животных, при изменении солености у проходных рыб (смолтификация) и т. д., также изменяют жирнокислотный состав мембранных липидов, приспосабливая свойства мембран к условиям среды и новым потребностям организма.
Гипотеза адаптационной роли мембранных липидов была выдвинута и обоснована Е.М. Крепсом. Согласно этой гипотезе при сравнении мембран мозга рыб разных сред обитания наиболее резкие различия в жирнокислотном составе обнаруживают ганглиозиды (гликолипиды). В этой же фракции наиболее быстро обнаруживаются изменения в наборе жирных кислот при смене температур и глубины обитания, а именно: понижение температуры и увеличение глубины синергично повышают содержание полиненасыщенных жирных кислот в составе ганглиозидов. Цереброзиды и сульфатиды (другие гликолипиды) адаптационной изменчивости не проявляют.
Компьютерное моделирование мембран, липид-II и покрывало Пенелопы


Чтобы обмануть многочисленных женихов, добивавшихся ее руки в то время, как Одиссей странствовал по морям, Пенелопа пошла на хитрость. Она объявила, что не может снова выйти замуж, не соткав погребальное покрывало своему свекру Лаэрту. Каждый день она ткала покрывало на глазах женихов и каждую ночь распускала его, когда никто не видел. Так ей удалось протянуть время и дождаться Одиссея.
Огромное количество клеточных процессов напоминают покрывало Пенелопы: те или иные вещества или структуры постоянно синтезируются и в то же время постоянно уничтожаются; тонкий баланс между этими двумя процессами обеспечивает существование клетки и организма в целом.
Взять хотя бы клеточную стенку, которая снаружи обволакивает бактериальные клетки и защищает их от всевозможных угроз из внешнего мира. В бактериальной клетке постоянно и одновременно идут два процесса: синтез этой стенки и ее разрушение. В результате стенка все время обновляется и обеспечивает бактерии качественную защиту. В этой статье мы поговорим об одном из липидов мембраны бактерий, липиде-II, который критически необходим для синтеза клеточной стенки. Этот липид, как челнок в ткацком станке Пенелопы, снует между внутренней и наружной поверхностями мембраны, поднося к клеточной стенке «строительные блоки», из которых она состоит. Также здесь будет рассказано о том, как с помощью компьютерного моделирования биомолекул удалось выяснить некоторые интимные закономерности существования липида-II.
Все живые существа состоят из огромного числа разнообразных молекул. Эти молекулы между собой взаимодействуют, разрушаются, синтезируются, меняют конформацию, перемещаются — одним словом, живут своей бурной молекулярной жизнью, обеспечивающей жизнь организма в целом. Поэтому нечего даже и говорить, как важно для биологии изучать тонкие взаимодействия между молекулами. Существует несколько методологических подходов к достижению этой цели.
1. in vivo (переводится как «в живом»). Можно взять живой организм и посмотреть, что творят там те или иные молекулы. С одной стороны, это — изучение молекулярных взаимодействий в условиях, максимально приближенных к боевым, и полученные результаты, скорее всего, будут иметь самое прямое отношение к тому, что происходит с молекулами в организме на самом деле. С другой стороны — это дорого (нужно разоряться на подопытных животных, на оборудование, на зарплату квалифицированных специалистов), долго и не всегда дает однозначный результат. Последнее связано с тем, что слишком уж много в живой системе разнообразных молекул, и четко проследить судьбу всего нескольких из них, как правило, невозможно, поскольку нельзя учесть все влияния, которым они могут подвергнуться.
2. in vitro («в стекле», то есть в пробирке). Можно взять не целый организм, а культуру клеток, либо только сами интересующие нас молекулы и, поместив их в пробирку или в чашку Петри, попытаться с помощью различных экспериментов выяснить, как молекулы общаются между собой. Это, как правило, дешевле и быстрее предыдущего способа, но результат дает довольно грубый, потому что законы существования клеток в культуре отличаются от таковых для клеток живого организма, а «голые» молекулы в пробирке и вовсе могут вести себя совершенно неподобающим образом (отнюдь не так, как в живой системе).
3. И наконец, in silico («в кремнии», то есть на компьютере, поскольку кремниевые полупроводники играют важную роль в работе компьютеров). Можно провести всё исследование на компьютере: задать свойства каждой молекулы с помощью специальных компьютерных программ и физических моделей, а затем рассчитать, что случится с этими молекулами в тех или иных ситуациях. Это самый дешевый, самый быстрый и самый грубый способ из всех описанных: мы совершенно точно не учтем всех тонкостей молекулярных взаимоотношений, зато сможем «малой кровью», не тратя много времени и денег, выяснить хотя бы приблизительные закономерности, которые потом проверим in vitro и in vivo. Кроме того, многие молекулярные нюансы вообще никак нельзя изучить, кроме как рассчитав на компьютере. Этому подходу (а точнее, вычислению с его помощью свойств липидных мембран) была посвящена лекция профессора Романа Гербертовича Ефремова на Зимней школе Современная биология и биотехногии будущего, прошедшей при поддержке Российской венчурной компании, Фонда «Династия» и РФФИ зимой 2013 года. И именно с помощью данного подхода и были выяснены некоторые закономерности поведения в мембране липида-II, описанные в статье группы Ефремова, опубликованной недавно в журнале Scientific reports. Поэтому сейчас мы поговорим об этом поподробнее. Но сначала вспомним, что же такое клеточная мембрана.
Мембрана
Цитоплазма клетки — это водный раствор различных (и очень разнообразных) веществ. Чтобы эти вещества не «растеклись», не разбежались в разные стороны, их надо отгородить от окружающего мира какой-то «загородкой», за которую они пройти не могут или же проникают с большим трудом. Роль такой загородки и играет липидная мембрана. И вот как ей это удается.


Головки липидов в силу своей «любви» к воде большей частью повернуты к наружным поверхностям мембраны, туда, где как раз и находится водная среда с растворенными в ней веществами. Хвосты же, ввиду своей «водобоязни» (или гидрофобности), прячутся в середине мембраны (там, где вода до них не доберется), образуя ее центральный гидрофобный слой (слоистая структура мембраны показана на заглавном рисунке к этой статье, а также на рисунках 2 и 3).
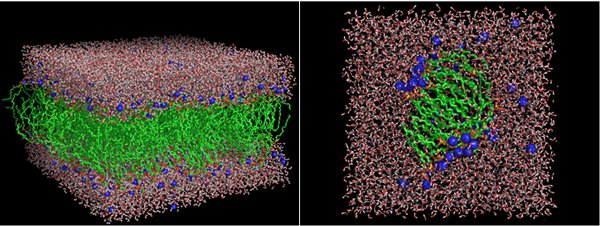
Рис. 2. Примеры полноатомных моделей липидного бислоя (слева) и мицеллы (справа). Зеленым цветом показаны гидрофобные хвосты липидов, красно-оранжевым — гидрофильные головки, синим — противоионы Na + , розовым — молекулы воды. Изображение из слайдов к лекции Р. Г. Ефремова на Зимней школе
Если вдруг молекула воды или какого-нибудь полярного (растворимого в воде) вещества попробует пробраться через липидную мембрану, ничего у нее не выйдет: за исключением очень редких случаев, она не сможет пройти через слой неполярных липидных хвостов, поскольку нерастворима в нем. Таким образом, тоненькая липидная пленка оказывается «крепостной стеной», обеспечивающей целостность клетки и не позволяющей цитоплазме растечься из этой клетки куда попало.
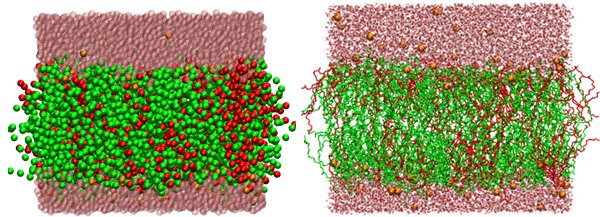
Рис. 3. Пример крупнозернистой модели липидного бислоя, образованного липидами палмитоилолеоилфосфатидилэтаноламином (ПОФЭ) и пальмитоилолеилфосфатидилглицерином (ПОФГ) (слева) и полноатомная модель того же бислоя, приведенная для сравнения (справа). Зеленым цветом показаны молекулы ПОФЭ, красным — ПОФГ, розовым — воды, а оранжевым — ионы натрия. Видно, что крупнозернистая модель не такая подробная, как полноатомная. Изображение из слайдов к лекции Р. Г. Ефремова на Зимней школе
Головки липидов могут быть самыми разными — крупными и мелкими, анионными (заряженными отрицательно), катионными (заряженными положительно) или цвиттерионными (имеющими в составе одновременно и положительно, и отрицательно заряженные группы). Хвосты тоже могут быть самыми разными — длинными и короткими, ненасыщенными (имеющими двойные связи между атомами углерода) и насыщенными (таких связей не имеющими). И каждое свойство головок и хвостов липидов накладывает отпечаток на характеристики мембраны. Например, насыщенные хвосты делают мембрану жестко структурированной, а ненасыщенные — наоборот, более жидкой и имеющей менее выраженную структуру. В результате из-за различного липидного состава мембраны разных клеток могут обладать совершенно разными свойствами. И вот мы, наконец, подошли к тому, как изучать эти свойства с помощью компьютерного моделирования.
Как изучать мембрану in silico
Есть несколько типов компьютерных моделей мембраны — от самых простых и грубых до тонких и подробных, но требующих гораздо более серьезных расчетов. Рассмотрим некоторые из них.
По сути дела, мембрана — это такой слоеный пирог. Его «начинка» — это гидрофобный (неполярный) слой липидных хвостов. С двух сторон от него располагаются гидрофильные (полярные) головки липидов, а снаружи от этих слоев находятся области связанных с головками молекул воды — это граница раздела неполярной и полярной сред. И наконец, самое наружное положение занимает полярная водная среда. При компьютерном моделировании этой системы можно в первом приближении, не углубляясь в подробности, задать некие характеристики для соответствующих слоев — неполярного, промежуточного и полярного — и просчитать, как будет вести себя получившаяся система в той или иной ситуации. То есть мы как бы «не говорим» компьютеру, что наша мембрана состоит из множества молекул липидов и воды, а сообщаем только, что она слоистая, и задаем свойства слоев. Мембранные модели такого типа называются неявно заданными и дают очень приблизительные результаты, зато и работают они достаточно быстро, а полученные данные можно проверить потом на других, более сложных и подробных моделях. Кроме того, при тщательной калибровке такие модели способны дать вполне адекватную картину — с учетом всех сделанных упрощений, конечно!
Можно удариться в другую крайность и создать модель, в которой в расчетах будут задействованы все атомы молекул липидов и воды для какого-то небольшого участка липидного бислоя. Такие модели называются полноатомными (рис. 2). Компьютерное моделирование в этом случае занимает гораздо больше времени, чем в случае неявно заданных систем, зато результаты получаются ближе к реальности. Основной алгоритм расчета при изучении подобных моделей, состоящих из набора взаимодействующих частиц, — классическая молекулярная динамика (МД).
Есть и промежуточный вариант — можно задать в модели не отдельные атомы молекулы липида, а целые группы атомов, обладающие определенными свойствами. Иными словами, мы как бы обрисовываем мембрану широкими мазками — несколько группировок атомов определяют гидрофильные свойства головки липида, другие несколько — гидрофобные свойства его хвоста. Такие модели называются «крупнозернистыми» (Coarse-grain); их обсчет требует намного меньше машинного времени по сравнению с полноатомными, а результат оказывается ближе к реальности, чем для неявно заданных моделей (рис. 3).
Помимо «натуральных» бислоев, можно обсчитывать и довольно «искусственные» образования — мицеллы (рис. 2, справа) и бицеллы. Это структуры, в которые собираются молекулы липидов, будучи предоставлены в растворе самим себе. На первый взгляд, в компьютерном моделировании таких структур нет никакого смысла, потому что они имеют весьма слабое отношение к реальной мембране. Однако это не так. Дело в том, что для изучения мембран различными «жизненными», некомпьютерными способами, например с помощью ЯМР-спектроскопии, используются именно мицеллы (Micelle) и бицеллы. Поэтому, сличив результаты компьютерного моделирования мицелл и бицелл со спектроскопическими данными, можно узнать, насколько близкое отношение компьютерная модель имеет к реальной жизни, и «откалибровать» эту модель в случае необходимости.
Еще один алгоритм компьютерного исследования мембран называется методом молекулярного гидрофобного потенциала (МГП). С помощью такого метода строится своеобразная «карта» гидрофобных свойств молекулы, на которой показаны участки большей или меньшей ее гидрофобности. Посмотрев на такую карту, можно понять, какая часть молекулы будет находиться только в водной среде, а какая, наоборот, кроме липидной среды ни на что не согласна (пример такой карты для молекулы лантибиотика низина показан на рис. 7). Можно строить карты не только для отдельных молекул, но и для целых участков мембран; такая карта поверхности мембраны показана на рисунке 6. О том, как именно строятся такие модели, подробнее рассказано в разделе «Как рассчитать гидрофобность теоретически?» статьи Антона Чугунова «Физическая водобоязнь».
А теперь перейдем, наконец, к более предметному разговору, вспомним про липид-II, о котором было рассказано во вступлении к данной статье, и посмотрим, как компьютерное моделирование мембраны помогло разобраться, что происходит с этим липидом в мембране бактерий.
Липид-II и почему он так важен
Как известно, бактерии окружены пептидогликановой (то есть состоящей из белков, обильно обвешанных углеводными остатками) клеточной стенкой, которая обволакивает бактерию снаружи и защищает ее от всевозможных перипетий внешнего мира. Липид-II (рис. 4) — один из липидов плазматической мембраны бактерий — занимается тем, что переносит пептидогликановые «строительные блоки», из которых состоит эта клеточная стенка, с внутренней стороны мембраны (где они синтезируются) на наружную (где встраиваются в клеточную стенку). Липид-II — молекула дефицитная: у грамположительных бактерий с толстой клеточной стенкой есть около 200 000 молекул липида-II на одну клетку, у грамотрицательных, у которых стенка гораздо тоньше, — всего около 2 000. Из-за того что этого липида в клетке так мало, он становится «бутылочным горлышком», узким местом синтеза бактериальной стенки; заблокировав его, можно нарушить этот синтез и лишить бактерию клеточной стенки, а, значит, и всяких шансов на выживание. Отдельным плюсом липида-II для разработчиков лекарств является консервативность его химической структуры: можно не бояться, что хитрые бактерии изменят эту молекулу так, что она будет неуязвима для придуманного против нее оружия, как это часто бывает в случае с белковыми мишенями лекарств, которые быстро мутируют, «уворачиваясь» от нацеленных на них лекарств.

Рис. 4. А — структура липида-II. У этой молекулы есть длинный, одиннадцатичленный, изопренольный хвост, через два фосфорных остатка соединенный со «строительным блоком» бактериальной клеточной стенки — двумя аминосахарами (N-ацетилглюкозамином, GlcNAc, и N-ацетилмураминовой кислотой, MurNAc) и короткой пентапептидной цепочкой. B — схема синтеза бактериальной клеточной стенки. Липид-II не до конца изученным способом (очевидно, с помощью каких-то ферментных комплексов) переправляет пептидогликановый строительный блок с внутренней стороны мембраны на наружную, где этот блок встраивается в клеточную стенку, а изопренольный хвост возвращается назад на внутреннюю часть мембраны, подхватывает там новый пептидогликановый блок, и цикл повторяется заново. Изображение из обзора Eefjan Breukink, Ben de Kruijff. Lipid-II as a target for antibiotics // Nature Reviews Drug Discovery, 2006
Существует особый класс антибиотиков под названием лантибиотики (Lantibiotics), которые как раз и занимаются избирательной блокировкой липида-II. Чтобы разрабатывать новые, более эффективные лантибиотики, надо понять, каким именно образом они «выключают» липид-II (данного липида в мембране ничтожное количество, и удивительно, как лантибиотики умудряются выловить его среди множества других молекул). И вот в этом, по крайней мере, на первых этапах, нам и может помочь компьютерное моделирование мембраны.
В данном исследовании использовали полноатомную модель бактериальной мембраны грамположительной бактерии. Вообще такая мембрана состоит из огромного числа разнообразных липидов, и просчитывать их все нецелесообразно из-за бесконтрольного увеличения сложности системы. Поэтому для упрощения работы (и, к сожалению, огрубления результатов) в компьютерной модели используют только два наиболее распространенных в данной мембране липида — пальмитоилолеилфосфатидилглицерин (ПОФГ; этот липид анионный, то есть имеет отрицательно заряженную головку) и палмитоилолеоилфосфатидилэтаноламин (ПОФЭ; этот липид цвиттерионный, то есть его головка несет и положительно, и отрицательно заряженные группы). Соотношение этих липидов составляло 3:1, что характерно для мембран грамположительных бактерий, несущих суммарный отрицательный заряд, а сама модель мембраны сокращенно называлась ФГ/ФЭ.
Первым делом исследователи посмотрели, как липид-II располагается в мембране. Выяснилось следующее (рис. 5). Пирофосфатная группа этого липида имеет более или менее строго заданное положение в пространстве: она находится на границе между водной средой и мембраной. Головка липида, содержащая «строительный блок» для клеточной стенки, плавает снаружи от мембраны в водной среде. Хвост же болтается внутри мембраны, принимая иногда самые причудливые положения. С практической точки зрения это означает, что именно выступающая из мембраны головка может быть тем местом, которое «распознают» и за которое цепляются лантибиотики.


Рис. 5. Возможные положения липида-II в мембране, полученные с помощью компьютерного моделирования молекулярной динамики. A — поперечный разрез мембраны, B — вид с внеклеточной стороны. Серые шарики — граница воды и липидной мембраны; молекулы фосфолипидов для ясности не показаны. Пирофосфатная группа липида-II (черный) имеет самое стабильное положение и располагается на границе водной среды и мембраны. Хвост (песочный), наоборот, очень подвижен, болтается внутри мембраны и может принимать самые причудливые положения. Остатки сахаров (MurNAc — красный, GlcNAc — оранжевый) расположены в водной среде вблизи мембраны и относительно подвижны; пентапептидная цепочка (ее аминокислоты показаны зеленым, голубым, синим, фиолетовым и пурпурным) еще подвижнее, и ее С-конец (показан розовыми шариками) может принимать самые разные положения в водной среде. Таким образом, кончик пентапептидной цепочки больше всего общается с водной средой и, как зонтик, загораживает от воды оставшуюся часть головки. Изображение из обсуждаемой статьи A. Chugunov et al. Lipid-II forms potential «landing terrain» for lantibiotics in simulated bacterial membrane, Scientific reports, 2013
Вообще, липид-II «наводит шороху» в ФГ/ФЭ мембране: головка его бугорком возвышается над поверхностью липидного бислоя, и даже на некотором отдалении от этой молекулы структура мембраны оказывается нарушена. К тому же, головка в силу своей полярности образует водородные связи с полярными головками фосфолипидов (особенно важную роль при этом играет пирофосфатная группа головки), а положительно заряженный остаток лизина на головке к тому же электростатически притягивает отрицательно заряженные участки окрестных липидов. В результате липид-II как бы «стягивает» на себя окрестные фосфолипидные молекулы. Хвост же, вертясь и крутясь внутри гидрофобного слоя, нарушает его структуру. В результате образуется паттерн, по форме похожий на океанский атолл: в середине его находится островок гидрофильности вокруг головки липида-II, а по краям — подковообразный гидрофобный участок, образованный за счет деятельности хвоста липида (рис. 6). Причем хвост, по-видимому, играет ведущую роль в образовании этого «атолла», поскольку усеченный липид-II с отрезанным хвостом никакого атолла образовать не может, а вот липид-III, который представляет из себя липид-II с отрезанной головкой, похожую структуру все же образует. Надо, конечно, сказать, что и без липида-II мембрана время от времени показывает некие нарушения структуры, но с липидом-II эти нарушения более стабильные и долгоживущие.


Рис. 6. Липид-II в бактериальной мембране образует гидрофильный «атолл». Карты молекулярного гидрофобного потенциала (МГП), которые показывают, что при появлении липида-II в модели ФГ/ФЭ-мембраны на этой мембране появляется подковообразный участок гидрофобности (коричневый), в середине которого находится гидрофильная область (голубая). Вся вместе эта структура напоминает океанский атолл. Синими кружками показаны атомы фосфора в ПОФГ, а зелеными — в ПОФЭ. Различные части липида-II показаны следующим образом: желтые треугольники — хвост, оранжевые кружочки — атомы фосфора, голубые кружочки — остатки сахара, а розовые кружочки — аминокислотные остатки. А — ФГ/ФЭ мембрана без липида-II, В — ФГ/ФЭ мембрана с липидом-II. Изображение из обсуждаемой статьи A. Chugunov et al. Lipid-II forms potential «landing terrain» for lantibiotics in simulated bacterial membrane, Scientific reports, 2013
Судя по всему, такие изменения структуры мембраны играют определенную роль при взаимодействии липида-II с лантибиотиками (рис. 7). Например, даже липид-III (на который лантибиотикам буквально некуда сесть в связи с отсутствием у него головки) в состоянии связываться с одним из лантибиотиков — низином; судя по всему, происходит это именно за счет взаимодействий низина с «атоллом», образовавшимся на мембране благодаря хвосту липида-III. Можно предположить, что в нормальных условиях, когда за липидом-II не охотится никакой лантибиотик, атолл необходим для распознавания липида-II ферментными комплексами, участвующими в его транспорте или в синтезе клеточной стенки.


Рис. 7. «Пирофосфатная клетка» — структура, возникающая, когда лантибиотик низин «вцепляется» в липид-II. Гидрофобная поверхность молекулы низина показана коричневым, а гидрофильная — голубым цветом. «Скелет» низиновой молекулы показан палочками внутри поверхности. Палочками снаружи поверхности показан фрагмент молекулы липида-II. Толстые палочки обозначают те области липида-II и низина, которые, по-видимому, играют решающую роль во взаимном распознавании этих молекул. Видно, что пространственные гидрофобные свойства низина повторяют таковые для «атолла», образующегося на бактериальной мембране вокруг молекулы липида-II: в середине находится гидрофильная (голубая), а по краям — гидрофобная (коричневая) области. Это может говорить о том, что «атолл» важен для распознавания липида-II лантибиотиками: они как бы «налипают» на атолл, сцепляясь с ним и гидрофобными, и гидрофильными областями, и за счет этого «ловят» липид-II. Это хорошее объяснение того, как лантибиотикам удается обнаружить столь редко встречающуюся молекулу среди множества других, казалось бы, на нее тоже похожих. Изображение из статьи A. Chugunov et al. Lipid-II forms potential «landing terrain» for lantibiotics in simulated bacterial membrane, Scientific reports, 2013
Для сравнения исследователи решили посмотреть, как ведет себя липид-II в мембране другого типа, цвиттерионной, образованной липидом пальмитоилолеилфосфатидилхолином (ПОФХ) и более соответствующей мембранам эукариот, нежели бактерий. На головках ПОФХ нет доноров водородных связей; из-за их отсутствия связь между головками слабее, чем в ФГ/ФЭ мембране, и поэтому ПОФХ-мембрана более жидкая и хуже структурированная.
И липид-II в такой мембране ведет себя куда более прилично и скромно. Головка его гораздо меньше выступает над поверхностью мембраны — не с кем образовать водородные связи, да и сама мембрана слишком жидкая и подвижная, в которой проще «утонуть», чем «высунуться». А главное — в ПОФХ-мембране липид-II не образует того амфифильного атолла, гидрофильного посередине и гидрофобного по краям, который так характерен для его поведения в ФГ/ФЭ-мембране. Видимо, это, опять же, связано с тем, что ПОФХ-мембрана более жидкая, подвижная и менее структурированная: хотя там часто случается, что гидрофобный участок выплескивается в гидрофильный слой, но такие изменения мимолетны; липид-II не может стабильно изменить поведение этой мембраны, и его присутствие в ней оказывается практически незаметным (ну, по крайней мере, по сравнению с присутствием в ФГ/ФЭ). Это говорит о том, что свою роль липид-II может выполнять только в «родной» бактериальной мембране, а очутившись в «чуждой» мембране с другим характером, он будет вести себя совершенно иначе и не сможет, видимо, распознаваться нужными ферментными комплексами и правильно выполнять свою функцию.
Подведем итог
А теперь в одном абзаце опишем выявленные взаимодействия.
Всё начинается с того, что липид-II нарушает структуру окрестной мембраны, создавая атоллоподобный участок, в центре которого находится гидрофильная, а по краям — гидрофобная области. Лантибиотики, судя по всему, имеют сходный паттерн распределения гидрофобности; попав на бактериальную мембрану, лантибиотик прилипает к тому месту, которое «близко ему по духу» (то есть как раз на возникший вокруг липида-II атолл), прикрепляется к липиду-II, блокирует его, нарушая таким образом синтез клеточной стенки, и этим убивает бактерию. Предполагаемый механизм начальных стадий распознавания лантибиотиками бактериальной мембраны, если он верен, может стать важной ступенькой в пути к дизайну новых (л)антибиотиков, лишенных бремени резистентности, уже не одно десятилетие довлеющего над антибиотиками XX века.
Предстоит еще проверить эту теорию in vitro и in vivo, но пока что она выглядит элегантно и правдоподобно. Мы же с вами немного разобрались в одном из того бесконечного числа процессов, которые обеспечивают существование клетки. Но всегда надо помнить, что помимо этого процесса в клетке происходит множество других, и покрывало Пенелопы ткется и распускается постоянно.
Источники:
1) Лекция Р. Г. Ефремова на Зимней школе «Молекулярная биология и биотехнологии будущего».
2) Anton Chugunov, Darya Pyrkova, Dmitry Nolde et al. Lipid-II forms potential «landing terrain» for lantibiotics in simulated bacterial membrane // Scientific Reports. 2006. V. 3. Article number: 1678.
3) Eefjan Breukink and Ben de Kruijff. Lipid-II as a target for antibiotics // Nature Reviews Drug Discovery. 2006. V. 5. P. 321–323.
Читайте также:

